Hơn 1.000 người cao tuổi Thủ đô được tư vấn, chăm sóc sức khỏe miễn phí
Hơn 1.000 người cao tuổi Thủ đô được tư vấn, chăm sóc sức khỏe miễn phí -
 Hơn 1.000 người cao tuổi Thủ đô được tư vấn, chăm sóc sức khỏe miễn phí
Hơn 1.000 người cao tuổi Thủ đô được tư vấn, chăm sóc sức khỏe miễn phí -
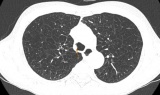 Hút thuốc nhiều năm, dấu hiệu khó thở báo động bệnh phổi mạn tính
Hút thuốc nhiều năm, dấu hiệu khó thở báo động bệnh phổi mạn tính -
 Tin mới y tế ngày 31/1: Thời tiết cận Tết thất thường, gia tăng nguy cơ viêm xoang ở trẻ em
Tin mới y tế ngày 31/1: Thời tiết cận Tết thất thường, gia tăng nguy cơ viêm xoang ở trẻ em -
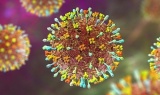 Virus Nipah xâm nhập cơ thể như thế nào và vì sao đặc biệt nguy hiểm
Virus Nipah xâm nhập cơ thể như thế nào và vì sao đặc biệt nguy hiểm -
Cảnh báo hệ lụy từ món ăn “quen thuộc” ngày Tết -
Tin mới y tế ngày 30/1: Bệnh thêm nặng vì tự ý điều trị tại nhà
Công văn 2997/QLD-CL của Cục Quản lý dược gửi Sở Y tế các tỉnh, thành phố trực thuộc trung ương; Công ty CP dược phẩm Nam Hà (địa chỉ: số 415, đường Hàn Thuyên, phường Vị Xuyên, TP. Nam Định, tỉnh Nam Định) nêu rõ thu hồi thuốc Viên nén Ubiheal 300 (Thioctic acid 300 mg), số GĐKLH: VD-27692-17, số lô: 22103; NSX: 17/11/2022; HD: 17/11/2025 trên địa bàn Hà Nội.
 |
| Ảnh minh họa |
Đồng thời, yêu cầu Công ty CP dược phẩm Nam Hà phối hợp với cơ quan kiểm tra chất lượng, cơ quan kiểm nghiệm thuốc Nhà nước tiến hành lấy 2 mẫu bổ sung và gửi mẫu đã lấy tới Viện Kiểm nghiệm thuốc Trung ương hoặc Viện Kiểm nghiệm thuốc TP.HCM để kiểm tra chất lượng đối với chỉ tiêu Độ hòa tan, Định lượng.
Trước đó, ngày 19/8/2024, Cục Quản lý Dược nhận được Công văn số 663/VKNTTW-KHTH của Viện Kiểm nghiệm thuốc Trung ương gửi kèm phiếu kiểm nghiệm số 54Gt42 ngày 15/8/2024 báo cáo kết quả lấy mẫu bổ sung đối với lô thuốc Viên nén Ubiheal 300 số lô: 22103; NSX: 17/11/2022; HD: 17/11/2025 nêu trên là không đạt tiêu chuẩn chất lượng về chỉ tiêu định lượng.
Như vậy lô thuốc viên nén Ubiheal 300 (Thioctic acid 300 mg), số GĐKLH: VD-27692-17, số lô: 22103; NSX: 17/11/2022; HD: 17/11/2025 nêu trên được xác định là vi phạm mức độ 2.
Ngoài thu hồi sản phẩm, Cục Quản lý dược yêu cầu Công ty CP dược phẩm Nam Hà phối hợp với nhà phân phối thuốc, trong thời hạn 2 ngày kể từ ngày ký công văn này phải gửi thông báo thu hồi tới các cơ sở bán buôn, bán lẻ, sử dụng viên nén Ubiheal 300 (Thioctic acid 300 mg), số GĐKLH: VD-27692-17, số lô: 22103; NSX: 17/11/2022; HD: 17/11/2025 do Công ty CP dược phẩm Nam Hà sản xuất và tiến hành thu hồi toàn bộ lô thuốc không đạt tiêu chuẩn chất lượng nêu trên.
Đồng thời, gửi báo cáo thu hồi về Cục Quản lý Dược trong vòng 18 ngày kể từ ngày ký công văn này. Hồ sơ thu hồi bao gồm số lượng sản xuất, số lượng phân phối, ngày sản xuất, số lượng thu hồi, các bằng chứng về việc thực hiện thu hồi tại các cơ sở bán buôn, bán lẻ, sử dụng đã mua thuốc theo quy định tại thông tư số 11/2018/TT-BYT ngày 4/5/2018 của Bộ Y tế quy định về chất lượng thuốc, nguyên liệu làm thuốc.
Cục Quản lý Dược yêu cầu Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, Y tế các ngành thông báo cho các cơ sở kinh doanh, sử dụng thuốc thu hồi lô thuốc Viên nén Ubiheal 300 (Thioctic acid 300 mg) không đạt chất lượng nêu trên.
Bên cạnh đó, công bố thông tin về quyết định thu hồi thuốc trên Trang thông tin điện tử của Sở, kiểm tra và giám sát các đơn vị thực hiện thông báo này; xử lý những đơn vị vi phạm theo quy định hiện hành; báo cáo về Cục Quản lý Dược và cơ quan chức năng có liên quan.
Đồng thời, Cục Quản lý Dược (Bộ Y tế) giao Sở Y tế Hà Nội, Sở Y tế tỉnh Nam Định kiểm tra và giám sát Công ty CP dược phẩm Nam Hà thực hiện việc thu hồi và xử lý thuốc bị thu hồi theo quy định.

-
Cảnh báo hệ lụy từ món ăn “quen thuộc” ngày Tết -
Tin mới y tế ngày 30/1: Bệnh thêm nặng vì tự ý điều trị tại nhà -
Hệ lụy khôn lường từ biến chứng áp xe sau tiêm chất làm đầy -
Mang Tết ấm áp đến với bệnh nhân ung thư -
Cảnh báo hệ lụy thói quen dùng thuốc lâu năm từ ca bệnh sốt kéo dài -
Đột quỵ tái diễn vì hẹp động mạch cảnh không được phát hiện sớm -
Tin mới y tế ngày 29/1: Trước nguy cơ dịch Nipah xâm nhập, Hà Nội giám sát chặt chẽ tại sân bay Nội Bài
-
 Phá đảo Coca-Cola Tết Fest 2026: Điểm check in cháy bậc nhất cuối tuần này ở TP.HCM
Phá đảo Coca-Cola Tết Fest 2026: Điểm check in cháy bậc nhất cuối tuần này ở TP.HCM -
 PV GAS tăng tốc kinh doanh quốc tế, hướng tới mục tiêu trở thành trung tâm LNG của khu vực
PV GAS tăng tốc kinh doanh quốc tế, hướng tới mục tiêu trở thành trung tâm LNG của khu vực -
 NCB bứt tốc năm 2025: Tăng vốn sớm, hoàn thành vượt mọi kế hoạch kinh doanh
NCB bứt tốc năm 2025: Tăng vốn sớm, hoàn thành vượt mọi kế hoạch kinh doanh -
 Năm 2025, doanh thu thuần của Điện Gia Lai (GEC) đạt gần 3.000 tỷ đồng
Năm 2025, doanh thu thuần của Điện Gia Lai (GEC) đạt gần 3.000 tỷ đồng -
 Đà Nẵng siết chặt quản lý giao dịch bất động sản: Pháp lý minh bạch trở thành tiêu chí hàng đầu
Đà Nẵng siết chặt quản lý giao dịch bất động sản: Pháp lý minh bạch trở thành tiêu chí hàng đầu -
 Agribank trao thưởng 1 tỷ đồng cho khách hàng gửi tiền tiết kiệm
Agribank trao thưởng 1 tỷ đồng cho khách hàng gửi tiền tiết kiệm