 Tết Bính Ngọ, hàng trăm trường hợp nhập viện nghi do pháo nổ
Tết Bính Ngọ, hàng trăm trường hợp nhập viện nghi do pháo nổ -
 Tết Bính Ngọ, hàng trăm trường hợp nhập viện nghi do pháo nổ
Tết Bính Ngọ, hàng trăm trường hợp nhập viện nghi do pháo nổ -
 Bộ trưởng Đào Hồng Lan: Đổi mới tư duy để y tế Việt Nam vươn mình trong kỷ nguyên mới
Bộ trưởng Đào Hồng Lan: Đổi mới tư duy để y tế Việt Nam vươn mình trong kỷ nguyên mới -
 Siết chặt “lá chắn” phòng dịch tại cửa khẩu, bệnh viện và cộng đồng
Siết chặt “lá chắn” phòng dịch tại cửa khẩu, bệnh viện và cộng đồng -
 Tin mới y tế ngày 17/2: Chào đón các công dân nhí của năm Bính Ngọ
Tin mới y tế ngày 17/2: Chào đón các công dân nhí của năm Bính Ngọ -
Cảnh báo nguy cơ ngộ độc từ rượu giả, thực phẩm bẩn dịp Tết -
Giao thừa cận kề, bệnh viện vẫn “trực chiến” giành giật sự sống cho bệnh nhân
Về nguyên tắc, để một vắc-xin được cấp phép thì phải đảm bảo được tính an toàn, tính sinh miễn dịch và hiệu lực bảo vệ. Căn cứ vào 3 yếu tố quan trọng này thì cơ quan chuyên môn mới xem xét vắc-xin có được cấp phép hay không.
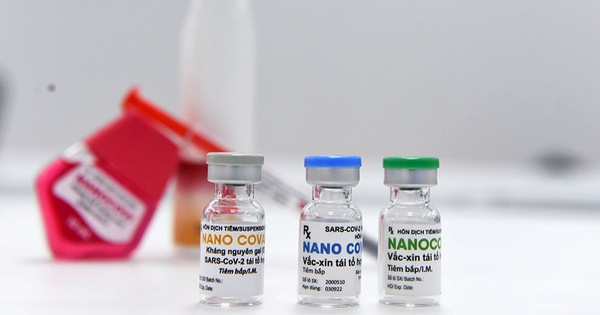 |
| Về nguyên tắc, để một vắc-xin được cấp phép thì phải đảm bảo được tính an toàn, tính sinh miễn dịch và hiệu lực bảo vệ. |
Chẳng hạn, tại Mỹ để một vắc xin được cấp phép khẩn cấp (EUA), Cơ quan Quản lý thực phẩm và dược phẩm (FDA) của Mỹ cần đánh giá xem liệu lợi ích mà vắc-xin mang lại có vượt qua những nguy cơ tiềm ẩn của nó hay không.
Đề nghị EUA đối với một chủng vắc-xin Covid-19 có thể được gửi tới FDA dựa trên phân tích thử nghiệm tính hiệu quả của vắc-xin ở giai đoạn 3 thử nghiệm lâm sàng hoặc phân tích nội bộ về giai đoạn thử nghiệm đó.
Trên phương diện độ an toàn, FDA yêu cầu một đơn xin EUA cần phải gửi kèm tất cả dữ liệu an toàn thu được từ giai đoạn 1 và giai đoạn 2 thử nghiệm vắc-xin.
Cùng với đó là cơ sở dữ liệu an toàn trong giai đoạn 3 thử nghiệm với hơn 3.000 người tham gia, tức đại diện cho một bộ phận lớn những người tham gia trong giai đoạn này - những người đã được theo dõi trong vòng ít nhất 1 tháng sau khi tiêm đầy đủ vắc-xin để xem có xuất hiện các phản ứng nghiêm trọng hay không.
Một phần trong quy trình đánh giá cấp phép EUA của FDA còn bao gồm đánh giá về thành phần hóa học, sản xuất và thông tin về vắc-xin.
Mọi thông tin đầy đủ cần được gửi cho FDA để đảm bảo chất lượng và tính nhất quán của vắc-xin. FDA sẽ sử dụng tất cả công cụ và thông tin sẵn có để đánh giá xem quy trình sản xuất vắc-xin đã đạt tiêu chuẩn của họ hay chưa.
Tại Việt Nam, với đề xuất của Nanogen đề nghị cấp phép khẩn cấp vắc-xin Nano Covax, GS. Nguyễn Anh Trí, nguyên Viện trưởng Viện Huyết học và Truyền máu Trung ương nêu quan điểm việc cấp phép cho vắc-xin cần cẩn trọng, đặt lợi ích sức khỏe người dân lên trên hết, trước hết.
Để đảm bảo độ tin cậy, theo GS. Trí, doanh nghiệp cần tiếp tục thử nghiệm lâm sàng giai đoạn 3 trên cỡ mẫu lớn hơn. “Nếu đốt cháy giai đoạn, nguy cơ một loại vắc-xin không an toàn ra cộng đồng khi ấy hậu quả khó lường”, GS. Nguyễn Anh Trí cho hay.
Tuy vậy, nguyên Viện trưởng Viện Huyết học và Truyền máu cũng đề nghị, khi doanh nghiệp nỗ lực hết sức thì bản thân các cơ quan quản lý cũng cần tạo mọi điều kiện, cắt giảm các thủ tục hành chính không cần thiết, tránh chậm chễ.
Là người theo dõi việc nghiên cứu và sản xuất vắc-xin của Công ty Nanogen từ những ngày đầu, ông Phạm Ngọc Đính, nguyên Phó viện trưởng Viện Vệ sinh dịch tễ Trung ương khẳng định, vắc-xin Nano Covax đảm bảo yêu cầu về khoa học, chất lượng, cũng như khía cạnh đạo đức.
Chuyên gia khẳng định, kết quả ban đầu cho thấy hiệu quả sinh miễn dịch của vắc-xin đáp ứng kháng thể với protein S1 đạt 99,4%. Đây là kháng thể chỉ điểm cho miễn dịch, trung hòa được virus sống.
"Chúng tôi tin rằng với tính nghiêm ngặt đảm bảo chất lượng, tính an toàn cho tình nguyện viên thử nghiệm giai đoạn 3, triển vọng của vắc-xin Nano Covax khá tốt", ông Đính nhận định.
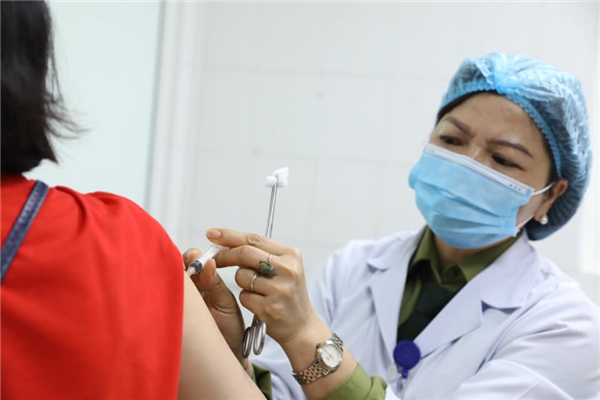 |
| Việc cấp phép cho vắc-xin cần cẩn trọng, đặt lợi ích sức khỏe người dân lên trên hết, trước hết. |
Nguyên Phó viện trưởng Viện Vệ sinh dịch tễ Trung ương cũng cho biết thêm, nếu thuận lợi, hy vọng tháng 10 chúng ta có được những lô vắc-xin Nano Covax đầu tiên tiêm chủng cho cộng đồng.
Tuy nhiên, theo chuyên gia, vắc-xin này vẫn phải thử nghiệm trên 13.000 người - số lượng lớn tương tự các ứng viên quốc tế. Sau đó Hội đồng sẽ có những tổng kết, đánh giá khách quan, nghiêm ngặt.
Còn theo ý kiến của GS. Phùng Đắc Cam, thành viên Hội đồng Đạo đức trong nghiên cứu y sinh học của Bộ Y tế, việc Nanogen đề nghị Thủ tướng Chính phủ cấp phép khẩn cấp vắc-xin Nano Covax là nóng vội vì doanh nghiệp chưa thử nghiệm xong giai đoạn 3.
Chưa kể, theo GS.Cam, kết quả thử nghiệm lâm sàng giai đoạn 2 vắc-xin phòng Covid-19 Nanocovax của Nanogen chưa được báo cáo qua Hội đồng Đạo đức trong nghiên cứu y sinh học của Bộ Y tế.
“Nanogen chưa báo cáo kết quả cho Hội đồng thì không thể khẳng định vắc-xin phòng Covid-19 Nanocovax có khả năng sinh miễn dịch đạt 99,4%. Do vậy chưa đủ điều kiện để xin cấp phép khẩn cấp vắc-xin phòng Covid-19 Nanocovax”, GS. Cam nêu.
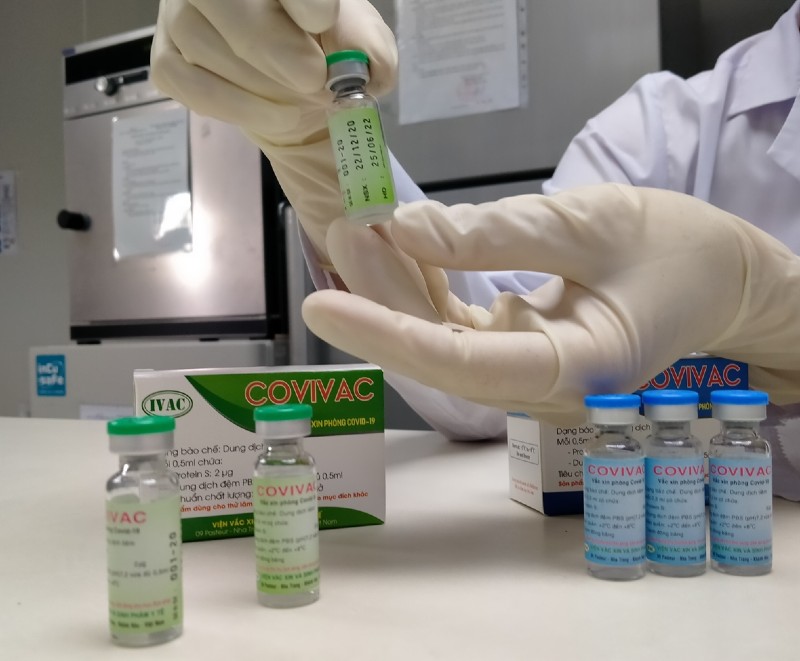 |
| Một vắc-xin muốn được cấp phép khẩn cấp cần phải thử nghiệm xong giai đoạn 3. |
Về phía Bộ Y tế, trong thông cáo gửi các cơ quan báo chí cơ quan này viện dẫn quy định của Tổ chức Y tế thế giới khẳng định một vắc-xin muốn được cấp phép khẩn cấp cần phải thử nghiệm xong giai đoạn 3.
Giai đoạn 3 được thực hiện trên quy mô lớn với mục tiêu đánh giá tính an toàn và hiệu quả bảo vệ của vắc-xin. Kết quả của giai đoạn 3 sẽ quyết định việc vắc-xin đó có được phê duyệt để triển khai tiêm chủng rộng rãi hay không.
Kể cả sau khi đã được phê duyệt, các loại vắc-xin đó đều phải liên tục bổ sung, cập nhật các thông tin, dữ liệu liên quan đến tính an toàn, hiệu quả của vắc-xin trong quá trình sử dụng.
Chỉ có kết quả thử nghiệm lâm sàng giai đoạn 3 mới là yếu tố quyết định để đánh giá vắc-xin này có hiệu quả bảo vệ hay không, có làm giảm nguy cơ mắc Covid-19 hay không hoặc giảm nhẹ tình trạng bệnh hay không.
Được biết, hiện tại Việt Nam đã phê duyệt có điều kiện cho 4 loại vắc-xin Covid-19 bao gồm: Comirnaty của Pfizer, A2D1222 của AstraZeneca, Sputnik-V của Gamalaya, Vero Cell của Sinopharm cho nhu cầu cấp bách trong phòng, chống dịch Covid.
Ngoài ra, vắc-xin Moderna cũng đang trong quá trình xem xét phê duyệt. Tất cả các vắc-xin nói trên đều phải trải qua 3 giai đoạn thử nghiệm lâm sàng.
Trong đó, thử nghiệm lâm sàng giai đoạn 3 có quy mô từ 20.000 đến 50.000 người tham gia. Cụ thể, vắc-xin của AstraZeneca thử nghiệm lâm sàng giai đoạn 3 tại 11 quốc gia với 49.626 người tham gia. Vắc-xin Vero Cell của Sinopharm thử nghiệm lâm sàng tại 6 quốc gia với trên 45.000 người.
Vắc-xin Sputnik-V thử nghiệm lâm sàng tại 5 quốc gia với 21.977 người. Vắc-xin của Pfizer thử nghiệm lâm sàng tại 6 quốc gia với 43.418 người và Vắc-xin của Moderna thử nghiệm tại 4 quốc gia với 30.420 người.
Ngày 22/6, Công ty Nanogen có văn bản gửi Thủ tướng Chính phủ mong muốn vắc-xin Nano Covax sớm được cấp phép khẩn, tương tự các loại của Nga, Trung Quốc và Ấn Độ.
Theo vị lãnh đạo của đơn vị này, vắc-xin Nano Covax đã chứng minh được những thành công bước đầu, Hội đồng đạo đức trong nghiên cứu y sinh chấp thuận và đánh giá tốt, kết quả thử nghiệm lâm sàng, khả năng sinh miễn dịch của vắc-xin Nano Covax đạt 99,4%.
Tuy nhiên, ông Nguyễn Ngô Quang, Phó cục trưởng Cục Khoa học công nghệ và Đào tạo, Bộ Y tế, cho rằng đây chỉ mới là tính sinh miễn dịch. Miễn dịch này có giảm được tỷ lệ mắc Covid-19 hoặc giảm nhẹ tình trạng bệnh hay không chưa có kết quả.
Theo ông Quang, loại vắc-xin này đang còn trong quá trình nghiên cứu, thử nghiệm và chưa có dữ liệu. Kiến nghị từ Công ty Nanogen lên Thủ tướng Chính phủ rất khó được chấp thuận bởi đây thuộc thẩm quyền chuyên môn của Bộ Y tế. Để quyết định có cấp phép khẩn cấp hay không, cơ quan này cần có các dữ liệu khoa học.
Giai đoạn 1: Vắc-xin được tiêm cho một nhóm nhỏ gồm những người khỏe mạnh để đánh giá độ an toàn khi tăng dần liều lượng và để thu được những thông tin sơ bộ về hiệu quả của vắc-xin trong việc sản sinh miễn dịch ở người. Nếu như không có vấn đề về an toàn trong thử nghiệm giai đoạn 1, giai đoạn 2 sẽ được bắt đầu.
Giai đoạn 2: Giai đoạn này được thực hiện với nhóm người lớn hơn, trong đó nhiều liều lượng khác nhau được thử nghiệm với hàng trăm người với tình trạng sức khỏe khác nhau và đến từ các nhóm tuổi khác nhau.
Những nghiên cứu này cung cấp thêm thông tin về độ an toàn của vắc-xin, như các tác dụng phụ ngắn hạn cùng các rủi ro, tìm hiểu mối liên hệ giữa liều lượng sử dụng và phản ứng miễn dịch, và có thể cung cấp thông tin ban đầu về tính hiệu quả của vắc-xin.
Giai đoạn 3: Vắc-xin thường được thử nghiệm trên hàng nghìn người ở nhiều nhóm tuổi khác nhau (ví dụ như nhóm tuổi dự định được tiêm vắc-xin) và cung cấp thông tin quan trọng về tính hieuj quả cũng như mức độ an toàn của vắc-xin.
Giai đoạn này cũng cung cấp thông tin thêm về phản ứng miễn dịch ở những người đã được tiêm vắc-xin so với những người được tiêm giả dược.
-
Ăn uống lành mạnh dịp Tết -
Cảnh báo nguy cơ ngộ độc từ rượu giả, thực phẩm bẩn dịp Tết -
Giao thừa cận kề, bệnh viện vẫn “trực chiến” giành giật sự sống cho bệnh nhân -
Đảm bảo an toàn thực phẩm trong dịp Tết -
Tin mới y tế ngày 16/2: Các bệnh lý tai mũi họng dễ bùng phát dịp Tết Nguyên đán -
Nghi ngộ độc sau ăn bánh mỳ, Bộ Y tế yêu cầu khẩn trương truy xuất nguồn gốc -
Phê duyệt "Chương trình Bảo đảm mức sinh thay thế trên toàn quốc đến năm 2030"
-
 DragonGroup: Khẳng định nền tảng, đặt mục tiêu bứt phá năm 2026
DragonGroup: Khẳng định nền tảng, đặt mục tiêu bứt phá năm 2026 -
 Agribank triển khai đồng bộ các giải pháp thúc đẩy tài chính toàn diện
Agribank triển khai đồng bộ các giải pháp thúc đẩy tài chính toàn diện -
 Khánh thành, thông xe công trình cầu vượt Thanh Hà
Khánh thành, thông xe công trình cầu vượt Thanh Hà -
 SATRA khai mạc chợ hoa xuân Bình Điền Bính Ngọ
SATRA khai mạc chợ hoa xuân Bình Điền Bính Ngọ -
 Techcombank Private: Kiến tạo tương lai quản lý gia sản tại Việt Nam
Techcombank Private: Kiến tạo tương lai quản lý gia sản tại Việt Nam -
 Vì sao nên sử dụng giải pháp vay kinh doanh của ngân hàng VietinBank?
Vì sao nên sử dụng giải pháp vay kinh doanh của ngân hàng VietinBank?