Tin mới y tế ngày 3/2: “Bệnh nghề nghiệp” thời hiện đại và giải pháp y học cho dân văn phòng
Tin mới y tế ngày 3/2: “Bệnh nghề nghiệp” thời hiện đại và giải pháp y học cho dân văn phòng -
 Tin mới y tế ngày 3/2: “Bệnh nghề nghiệp” thời hiện đại và giải pháp y học cho dân văn phòng
Tin mới y tế ngày 3/2: “Bệnh nghề nghiệp” thời hiện đại và giải pháp y học cho dân văn phòng -
 Phát hiện u dưới niêm mạc dạ dày khi khám định kỳ
Phát hiện u dưới niêm mạc dạ dày khi khám định kỳ -
 Phân cấp mạnh kiểm tra an toàn thực phẩm cho địa phương, giảm ách tắc hàng nhập khẩu
Phân cấp mạnh kiểm tra an toàn thực phẩm cho địa phương, giảm ách tắc hàng nhập khẩu -
 Bữa cơm tất niên ấm áp của bệnh nhân ung thư
Bữa cơm tất niên ấm áp của bệnh nhân ung thư -
Ra mắt Cổng bảo lãnh thanh toán viện phí -
Cảnh báo ngộ độc rượu pha cồn công nghiệp
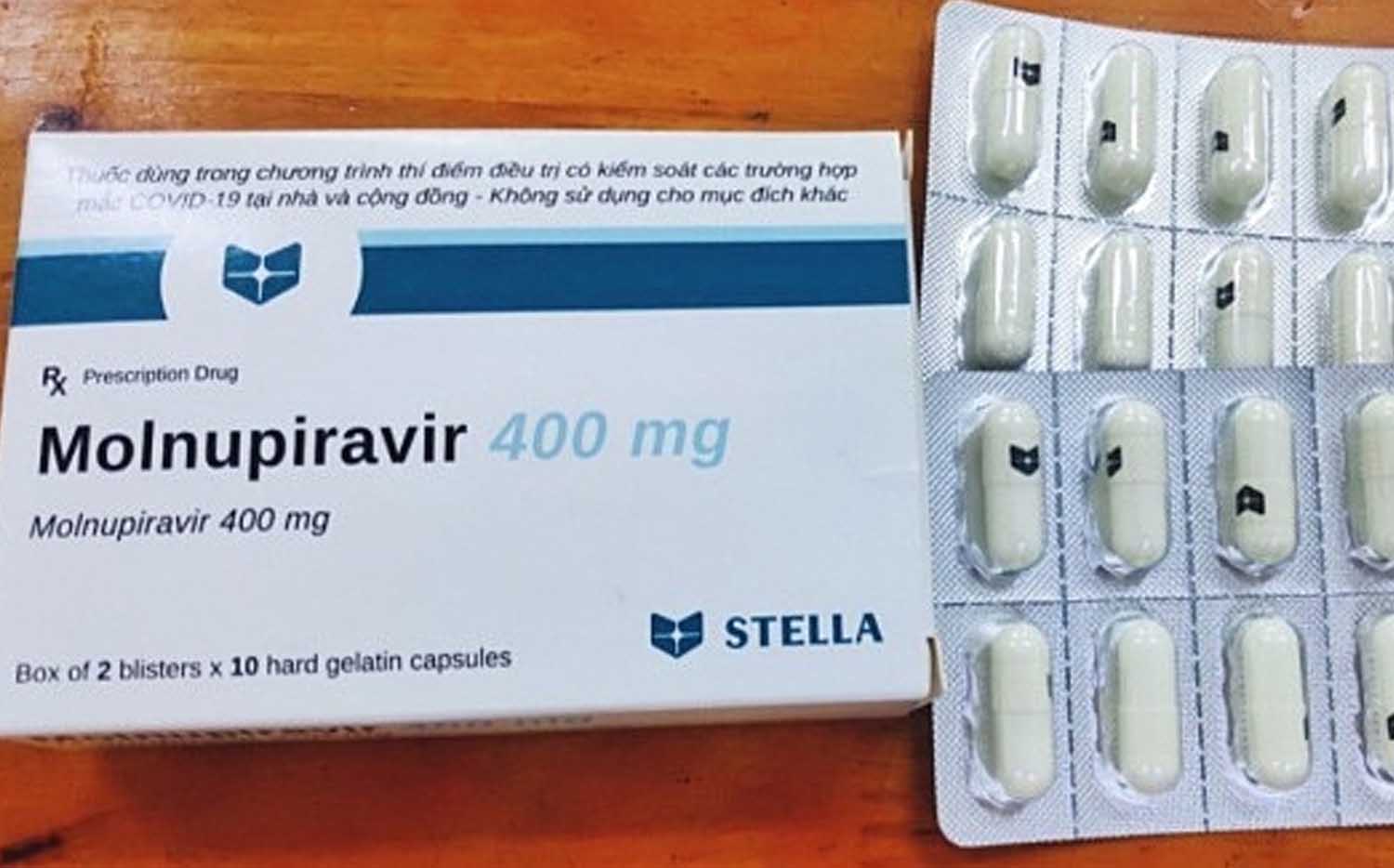 |
| Ảnh minh họa |
Vũ khí quan trọng trong điều trị F0
Ngày 5/1/2022, Hội đồng Tư vấn cấp giấy phép thuốc và nguyên liệu làm thuốc đã họp để xem xét cấp số đăng ký 4 loại thuốc chứa hoạt chất Molnupiravir cho 4 công ty dược trong nước; 6 đơn vị đang bổ sung hồ sơ để xem xét họp vào đợt sau.
Trước đó, 1 tấn nguyên liệu để bào chế 4,75 triệu viên nén Molnupiravir thương hiệu Movinavir 200 mg điều trị Covid-19 của Optimus Pharma (Ấn Độ) đã theo chuyên cơ đoàn công tác của Chủ tịch Quốc hội Vương Đình Huệ về Việt Nam và bàn giao cho Công ty cổ phần Hóa - Dược phẩm Mekophar.
Mekophar là doanh nghiệp được ủy quyền sản xuất viên nén Molnupiravir mang thương hiệu Movinavir, được bảo hộ thương hiệu toàn cầu. Movinavir đang được MHRA (cơ quan quản lý thuốc và các sản phẩm chăm sóc sức khỏe) của Anh chấp thuận hồ sơ và sẽ được cấp phép chuẩn thuận thời gian ngắn trong vòng 10 ngày, qua đó sẽ được bán và tiêu thụ tại châu Âu và Anh.
Thủ tướng Phạm Minh Chính yêu cầu, Bộ Y tế cần chủ trì, phối hợp với các cơ quan, đơn vị liên quan khẩn trương rà soát, hoàn thiện thể chế, hành lang pháp lý, bổ sung các cơ chế, chính sách cần thiết để hỗ trợ, thúc đẩy sản xuất vắc-xin, sinh phẩm, trang thiết bị, thuốc điều trị Covid-19 trong nước; vấn đề thuộc thẩm quyền của cấp nào thì đề xuất cấp đó tháo gỡ trên tinh thần tôn trọng, bám sát thực tiễn; nâng cao năng lực quản lý nhà nước trong lĩnh vực này.
Bà Huỳnh Thị Lan, Tổng giám đốc Mekophar thông tin, đơn vị đã nộp hồ sơ đăng ký - thẩm định và đang chờ ý kiến từ phía Bộ Y tế. Chỉ cần có ý kiến đồng thuận, cấp số đăng ký lưu hành, đơn vị sẽ bắt tay ngay vào sản xuất.
Liên quan tới việc sản xuất Molnupiravir, ông Phạm Sanh Châu (Đại sứ Việt Nam tại Ấn Độ) cho biết, các công ty Việt Nam đang làm việc với Ấn Độ để nhập nguyên liệu chuẩn bị cho sản xuất khi được Bộ Y tế cấp số đăng ký.
Molnupiravir là hoạt chất trong thuốc, có tác dụng kháng virus, đang trong giai đoạn thử nghiệm và chưa được cấp phép lưu hành tại Việt Nam. Đây được xem là vũ khí quan trọng trong điều trị F0 tại nhà, do tác dụng giảm lượng virus ở giai đoạn đầu mắc bệnh, từ đó giảm nguy cơ trở nặng và tử vong.
Cơ quan Quản lý dược phẩm và thực phẩm Mỹ (FDA) đang xem xét các dữ liệu lâm sàng cho quyết định cấp phép lưu hành thuốc. Các quốc gia châu Á, trong đó có Ấn Độ, cũng đang rà soát dữ liệu lâm sàng đối với các thuốc được công ty phát minh là MSD nhượng quyền sản xuất, cũng như các thuốc chưa được MSD nhượng quyền, để xem xét việc cấp giấy đăng ký lưu hành thuốc.
Giảm thời gian, thủ tục
Theo đại diện Vụ Pháp chế (Bộ Y tế), một loại thuốc muốn được Bộ Y tế xét duyệt, cấp phép đăng ký lưu hành thường phải mất 2-3 năm. Bên cạnh đó, Luật Dược quy định, thuốc mới đăng ký lưu hành phải có hồ sơ thử nghiệm lâm sàng. Song Molnupiravir mới thử nghiệm trên quy mô nhỏ, chưa thể đáp ứng.
Để gỡ vướng mắc, trong dự thảo vừa trình Chính phủ, Bộ Y tế đề xuất, thuốc mới có chỉ định sử dụng phòng, điều trị Covid-19 sản xuất trong nước được miễn nộp hồ sơ lâm sàng, nếu có cùng hoạt chất, dạng bào chế, đường dùng với thuốc có chỉ định sử dụng phòng, điều trị Covid-19 đã được một trong các cơ quan quản lý dược thuộc danh sách SRA (Cơ quan Quản lý dược nghiêm ngặt theo Tổ chức Y tế thế giới) cấp phép lưu hành.
“Nếu đề xuất này được thông qua, các đơn vị có thể sản xuất thuốc chứa hoạt chất Molnupiravir tại Việt Nam”, đại diện Vụ Pháp chế nêu.
Ông Trần Văn Thuấn, Thứ trưởng Bộ Y tế khẳng định, Bộ Y tế sẽ tiếp tục cập nhật các thông tin khoa học của thuốc, cũng như tình hình cấp phép sử dụng tại các quốc gia, làm cơ sở báo cáo Chính phủ và các cơ quan chức năng cho phép cấp phép sử dụng khẩn cấp tại Việt Nam trong thời gian sớm nhất.
Về lộ trình sản xuất thuốc điều trị Covid-19, PGS-TS. Đỗ Văn Dũng, Trưởng khoa Y tế công cộng (Trường đại học Y dược TP.HCM) cho rằng, vấn đề hiện nay của thuốc Molnupiravir là chuyển giao công nghệ, còn nguyên liệu và năng lực sản xuất trong nước đều có thể đáp ứng.
Theo tìm hiểu, tại Việt Nam, Viện Hóa sinh biển (Viện hàn lâm Khoa học và công nghệ Việt Nam) đã nghiên cứu và công bố thành công việc tạo ra quy trình tổng hợp và tinh chế hoạt chất Molnupiravir quy mô pilot (quy mô lớn hơn nhiều so với quy mô phòng thí nghiệm, nhưng nhỏ hơn quy mô sản xuất). Mới đây, đơn vị này đã ký kết hợp đồng chuyển giao quy trình sản xuất Molnupiravir quy mô pilot cho một công ty dược phẩm với mong muốn nhanh chóng có thuốc Molnupiravir của Việt Nam.
Theo thông tin từ Cổng Thông tin của Bộ Y tế, Viện Hóa sinh biển còn nghiên cứu các loại thuốc điều trị và đã đạt được những thành công, như xây dựng được quy trình tổng hợp thuốc Favipiravir quy mô phòng thí nghiệm; nghiên cứu thành công giai đoạn tiền lâm sàng thuốc thử nghiệm điều trị Covid-19 từ thảo dược.

-
Ra mắt Cổng bảo lãnh thanh toán viện phí -
Cảnh báo ngộ độc rượu pha cồn công nghiệp -
Bộ Y tế yêu cầu tăng cường kiểm tra việc thực hiện chính sách, pháp luật về bảo hiểm y tế -
Bộ Y tế yêu cầu tăng cường phòng ngừa ngộ độc thực phẩm dịp Tết, lễ hội -
Tin mới y tế ngày 2/2: Viêm tụy cấp vì lạm dụng rượu bia dịp cuối năm -
Hà Nội chủ động kiểm soát dịch bệnh truyền nhiễm ngay từ đầu năm -
Tin mới y tế ngày 1/2: Điều trị đích mở ra hy vọng cho bệnh nhân ung thư phổi
-
 Doanh nghiệp cần tái cấu trúc tư duy quản trị để chuyển đổi số bền vững
Doanh nghiệp cần tái cấu trúc tư duy quản trị để chuyển đổi số bền vững -
 Coca-Cola và Hội chữ thập đỏ Việt Nam triển khai gói hỗ trợ 6,7 tỷ đồng dịp Tết 2026
Coca-Cola và Hội chữ thập đỏ Việt Nam triển khai gói hỗ trợ 6,7 tỷ đồng dịp Tết 2026 -
 SơnKim Group đồng hành cùng giải golf Long Bình Open
SơnKim Group đồng hành cùng giải golf Long Bình Open -
 Đức Long Gia Lai: Lợi nhuận năm 2025 tăng gấp 2,5 lần kế hoạch đề ra
Đức Long Gia Lai: Lợi nhuận năm 2025 tăng gấp 2,5 lần kế hoạch đề ra -
 Những dấu ấn phát triền của SeABank năm 2025
Những dấu ấn phát triền của SeABank năm 2025 -
 Kusto Home ký kết hợp tác phân phối dự án The Reflection West Lake
Kusto Home ký kết hợp tác phân phối dự án The Reflection West Lake