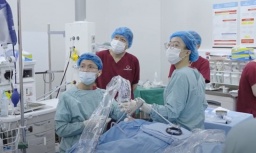
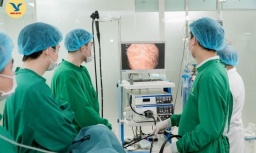
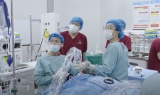
 Tin mới y tế ngày 4/2: Kỹ thuật hiện đại điều trị ung thư tiêu hóa hiếm gặp
Tin mới y tế ngày 4/2: Kỹ thuật hiện đại điều trị ung thư tiêu hóa hiếm gặp -
 Tin mới y tế ngày 4/2: Kỹ thuật hiện đại điều trị ung thư tiêu hóa hiếm gặp
Tin mới y tế ngày 4/2: Kỹ thuật hiện đại điều trị ung thư tiêu hóa hiếm gặp -
 Hà Nội công bố 234 điểm bán thuốc trực xuyên Tết Bính Ngọ
Hà Nội công bố 234 điểm bán thuốc trực xuyên Tết Bính Ngọ -
 Tin mới y tế ngày 3/2: “Bệnh nghề nghiệp” thời hiện đại và giải pháp y học cho dân văn phòng
Tin mới y tế ngày 3/2: “Bệnh nghề nghiệp” thời hiện đại và giải pháp y học cho dân văn phòng -
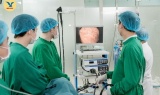 Phát hiện u dưới niêm mạc dạ dày khi khám định kỳ
Phát hiện u dưới niêm mạc dạ dày khi khám định kỳ -
Phân cấp mạnh kiểm tra an toàn thực phẩm cho địa phương, giảm ách tắc hàng nhập khẩu -
Bữa cơm tất niên ấm áp của bệnh nhân ung thư
Phạt tiền, tiêu hủy thuốc do vi phạm chất lượng
Thanh tra Bộ Y tế vừa có quyết định xử phạt vi phạm hành chính đối với Công ty S.C Slavia Pharma S.R.L (Romania) 70.000.000 đồng do đã thực hiện hành vi vi phạm hành chính: Sản xuất thuốc viên nén Zovitit, số GĐKLH: VN-15819-12, số lô: 0017, NSX: 03/05/23, HSD: 02/05/26 vi phạm chất lượng mức độ 2 theo quy định của pháp luật.
 |
| Ảnh minh họa |
Hành vi trên vi phạm quy định tại khoản 5 Điều 4 và điểm b khoản 4 Điều 57 Nghị định 117/2020/NĐ-CP ngày 28/9/2020 của Chính phủ quy định xử phạt vi phạm hành chính trong lĩnh vực y tế.
Thanh tra Bộ Y tế buộc công ty tiêu hủy 27.580 viên thuốc Zovitit vi phạm chất lượng mức độ 2 nêu trên, Công ty S.C Slavia Pharma S.R.L(Romania) sản xuất, Công ty Cổ phần dược phẩm Cudopha nhập khẩu.
Cùng với xử phạt bằng tiền 70 triệu đồng, Thanh tra Bộ Y tế còn buộc Công ty S.C Slavia Pharma S.R.L phải tiêu hủy 27.580 viên thuốc Zovitit vi phạm chất lượng mức độ 2.
Thanh tra Bộ Y tế yêu cầu Công ty S.C Slavia Pharma S.R.L(Romania) phải nghiêm chỉnh chấp hành quyết định xử phạt này. Nếu quá thời hạn mà Công ty S.C Slavia Pharma S.R.L(Romania) không tự nguyện chấp hành thì sẽ bị cưỡng chế thi hành theo quy định của pháp luật.
Zovitit là thuốc được chỉ định điều trị nhiễm virus Herpes simplex, phòng ngừa tái nhiễm Herpes sinh dục, suy giảm miễn dịch...
Gần 800 thuốc, nguyên liệu trong nước được Bộ Y tế gia hạn giấy đăng ký lưu hành
Cục Quản lý Dược (Bộ Y tế) vừa gia hạn 771 sản phẩm thuốc, nguyên liệu làm thuốc sản xuất trong nước.
Trong số này có, 556 thuốc, nguyên liệu làm thuốc sản xuất trong nước được gia hạn giấy đăng ký lưu hành hiệu lực 5 năm; 159 thuốc sản xuất trong nước được gia hạn giấy đăng ký lưu hành hiệu lực 3 năm; 56 thuốc sản xuất trong nước gia hạn giấy đăng ký lưu hành đến ngày 31/12/2025.
Các sản phẩm thuốc, nguyên liệu làm thuốc sản xuất trong nước được gia hạn giấy đăng ký lưu hành lần này khá đa dạng về nhóm tác dụng dược lý như nhóm thuốc điều trị nhiễm khuẩn đường hô hấp; thuốc điều trị thoái hóa khớp..; thuốc điều trị tim mạch, tăng huyết áp, đái tháo đường, điều trị ung thư, thuốc kháng virus, thuốc kháng sinh, giảm đau, kháng viêm...
Có sản phẩm dưới dạng bào chế viên nén bao phim, có sản phẩm dạng dung dịch dùng ngoài, viên nang cứng, thuốc bột pha hỗn dịch, thuốc viên nén phân tán...
Cục Quản lý Dược yêu cầu cơ sở sản xuất và cơ sở đăng ký thuốc có trách nhiệm sản xuất, cung cấp thuốc vào Việt Nam theo đúng các hồ sơ, tài liệu đã đăng ký với Bộ Y tế và phải in hoặc dán số đăng ký được Bộ Y tế cấp lên nhãn thuốc;
Cùng đó, thực hiện việc cập nhật tiêu chuẩn chất lượng của thuốc theo quy định tại Thông tư số 11/2018/TT-BYT ngày 4/5/2018 của Bộ trưởng Bộ Y tế quy định về chất lượng thuốc, nguyên liệu làm thuốc, Thông tư số 03/2020/TT-BYT ngày 22/01/2020 của Bộ trưởng Bộ Y tế sửa đổi, bổ sung một số điều của Thông tư 11/2018/TT-BYT quy định về chất lượng thuốc, nguyên liệu làm thuốc.
Thuốc được gia hạn giấy đăng ký lưu hành tại Quyết định này nhưng chưa nộp hồ sơ cập nhật nội dung nhãn thuốc, tờ hướng dẫn sử dụng thuốc theo quy định của Thông tư 01/2018/TT-BYT ngày 18/01/2018 của Bộ trưởng Bộ Y tế thì phải thực hiện cập nhật theo quy định tại điểm b Khoản 1 Điều 37 Thông tư số 01/2018/TT-BYT trong thời hạn 12 tháng kể từ ngày được gia hạn giấy đăng ký lưu hành.
Trong thời hạn 12 tháng kể từ ngày được gia hạn giấy đăng ký lưu hành theo Quyết định này có thay đổi về nội dung hành chính phải sản xuất và lưu hành với các nội dung đã được phê duyệt thay đổi trong hồ sơ gia hạn.
Cơ sở đăng ký thuốc phải bảo đảm duy trì điều kiện hoạt động trong thời hạn hiệu lực của giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc.
Gần 160.000 người tử vong vì đột quỵ do tắc mạch não, xuất huyết não
GS-TS.Đỗ Doãn Lợi, Phó chủ tịch Hội Tim mạch cho biết, theo Tổ chức Y tế thế giới (WHO), năm 2020, Việt Nam có gần 160.000 người tử vong vì đột quỵ do tắc mạch não, xuất huyết não.
Thông thường cứ 3 người bị đột quỵ do thiếu máu cục bộ thì 2 người sẽ tử vong hoặc gặp các di chứng nặng cần người chăm sóc trong vòng 5 năm sau đột quỵ.
Với đột quỵ do xuất huyết, cứ 4 người thì 3 người tử vong hoặc để lại biến chứng, cần người chăm sóc nhiều năm. Còn với nhồi máu cơ tim, tỷ lệ sống sót chỉ khoảng 60% và cũng để lại tình trạng tàn phế, gây ra gánh nặng cho gia đình và xã hội.
Đáng báo động là tình trạng bệnh nhân bị đột quỵ và nhồi máu cơ tim đang có xu hướng trẻ hóa. 20% số bệnh nhân nhồi máu cơ tim trên thế giới là dưới 40 tuổi.
Còn tại Việt Nam, các bệnh viện chuyên ngành tim mạch, đột quỵ ghi nhận nhiều bệnh nhân chỉ hơn 20 tuổi đến hơn 30 đã bị đột quỵ và nhồi máu cơ tim.
Nguyên nhân là do giới trẻ hiện nay đang sống theo "trend", ăn nhiều đồ ăn nhanh, nghiện thuốc lá, uống nhiều rượu, bia, chất kích thích, nước ngọt có ga, sử dụng điện thoại, máy tính liên tục, sống vội vã căng thẳng và ít vận động. Đây là những yếu tố nguy cơ dẫn đến bệnh đột quỵ và nhồi máu cơ tim.
Đưa ra lời khuyên đối với người trẻ, GS-TS.Đỗ Doãn Lợi cho biết, muốn sống khỏe phải xác định cân bằng giữa công việc và cuộc sống. Tránh rượu bia, thuốc lá, tăng cường vận động thể lực nhiều hơn.
Theo các chuyên gia, nguy cơ chính gây ra các bệnh tim mạch ở người Việt Nam được xếp theo thứ tự từ cao đến thấp gồm huyết áp cao, hút thuốc lá, đường máu cao, mỡ máu cao và béo phì.
Như vậy, đối với người Việt Nam, việc cải thiện tình trạng tăng huyết áp, bệnh tiểu đường, tăng mỡ máu, béo phì...; không lạm dụng rượu bia, không hút thuốc, kiểm soát cân nặng hợp lý, vận động, tập thể dục phù hợp sẽ giúp giảm nguy cơ mắc các bệnh về tim mạch”.
Theo WHO, bệnh đột quỵ và nhồi máu cơ tim có tỷ lệ mắc rất cao, nhưng đại đa số các yếu tố nguy cơ chính gây ra 2 bệnh này lại có thể phòng ngừa được.

-
Phân cấp mạnh kiểm tra an toàn thực phẩm cho địa phương, giảm ách tắc hàng nhập khẩu -
Bữa cơm tất niên ấm áp của bệnh nhân ung thư -
Ra mắt Cổng bảo lãnh thanh toán viện phí -
Cảnh báo ngộ độc rượu pha cồn công nghiệp -
Bộ Y tế yêu cầu tăng cường kiểm tra việc thực hiện chính sách, pháp luật về bảo hiểm y tế -
Bộ Y tế yêu cầu tăng cường phòng ngừa ngộ độc thực phẩm dịp Tết, lễ hội -
Tin mới y tế ngày 2/2: Viêm tụy cấp vì lạm dụng rượu bia dịp cuối năm
-
 Doanh nghiệp cần tái cấu trúc tư duy quản trị để chuyển đổi số bền vững
Doanh nghiệp cần tái cấu trúc tư duy quản trị để chuyển đổi số bền vững -
 Coca-Cola và Hội chữ thập đỏ Việt Nam triển khai gói hỗ trợ 6,7 tỷ đồng dịp Tết 2026
Coca-Cola và Hội chữ thập đỏ Việt Nam triển khai gói hỗ trợ 6,7 tỷ đồng dịp Tết 2026 -
 SơnKim Group đồng hành cùng giải golf Long Bình Open
SơnKim Group đồng hành cùng giải golf Long Bình Open -
 Đức Long Gia Lai: Lợi nhuận năm 2025 tăng gấp 2,5 lần kế hoạch đề ra
Đức Long Gia Lai: Lợi nhuận năm 2025 tăng gấp 2,5 lần kế hoạch đề ra -
 Những dấu ấn phát triền của SeABank năm 2025
Những dấu ấn phát triền của SeABank năm 2025 -
 Kusto Home ký kết hợp tác phân phối dự án The Reflection West Lake
Kusto Home ký kết hợp tác phân phối dự án The Reflection West Lake