Dịp Tết: Hạn chế thực phẩm chế biến sẵn để giảm gánh nặng bệnh không lây nhiễm
Dịp Tết: Hạn chế thực phẩm chế biến sẵn để giảm gánh nặng bệnh không lây nhiễm -
 Dịp Tết: Hạn chế thực phẩm chế biến sẵn để giảm gánh nặng bệnh không lây nhiễm
Dịp Tết: Hạn chế thực phẩm chế biến sẵn để giảm gánh nặng bệnh không lây nhiễm -
 Cúm mùa dễ lây lan mùa lễ hội, du Xuân: Tiêm vắc-xin để chủ động phòng ngừa
Cúm mùa dễ lây lan mùa lễ hội, du Xuân: Tiêm vắc-xin để chủ động phòng ngừa -
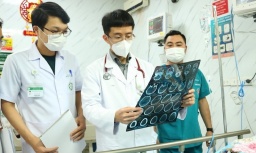
 Tin mới y tế ngày 13/2: Kiểm soát yếu tố nguy cơ, phòng đột quỵ não trong dịp Tết
Tin mới y tế ngày 13/2: Kiểm soát yếu tố nguy cơ, phòng đột quỵ não trong dịp Tết -
 Nhận biết sớm dấu hiệu tan máu bẩm sinh để tránh biến chứng
Nhận biết sớm dấu hiệu tan máu bẩm sinh để tránh biến chứng -
Hơn 1.000 người bệnh ung thư về quê trên hành trình Chuyến xe yêu thương -
Hành trình IVF gian nan của cặp vợ chồng hiếm muộn đón cái Tết đầu tiên bên con thơ
Vắc-xin Moderna do Công ty Rovi Pharma Industrial Services, S.A, Tây Ban Nha và Recipharm Monts, Pháp sản xuất và được chi nhánh Công ty TNHH Zuellig Pharma Việt Nam đề xuất phê duyệt gửi Bộ Y tế Việt Nam.
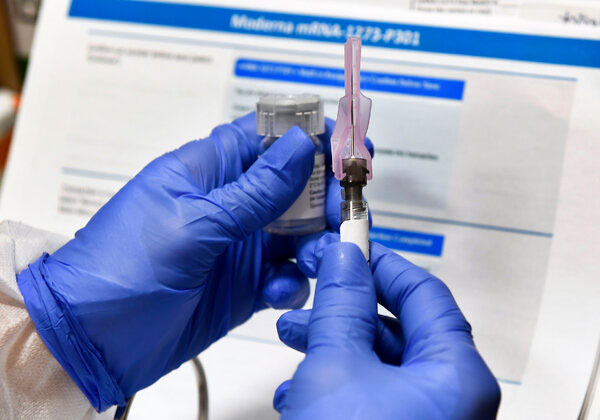 |
| Bộ Y tế phê duyệt có điều kiện vắc-xin cho nhu cầu cấp bách trong phòng, chống dịch bệnh Covid-19 đối với vắc-xin Spikevax - tên khác là vắc-xin Moderna. |
Vắc-xin Moderna được phê duyệt dựa trên dữ liệu an toàn, chất lượng và hiệu quả do Chi nhánh Công ty TNHH Zuellig Pharma Việt Nam cung cấp cho Bộ Y tế Việt Nam tính đến ngày 23/6/2021 và cam kết của Chi nhánh Công ty TNHH Zuellig Pharma Việt Nam về tính chính xác của các tài liệu đã cung cấp cho Bộ Y tế Việt Nam.T
Chi nhánh Công ty TNHH Zuellig Pharma Việt Nam có trách nhiệm phối hợp với cơ sở sản xuất vắc-xin phản hồi kịp thời các yêu cầu từ Bộ Y tế Việt Nam để bổ sung thêm dữ liệu hoặc các yêu cầu khác có liên quan đến vắc-xin Moderna và chủ động cung cấp, cập nhật các thông tin mới có liên quan đến vắc-xin Moderna cho Bộ Y tế Việt Nam trong suốt quá trình phát triển sản phẩm;
Chi nhánh Công ty TNHH Zuellig Pharma Việt Nam chịu trách nhiệm phối hợp với cơ sở sản xuất vắc-xin đảm bảo các điều kiện sản xuất tại cơ sở sản xuất vắc-xin Moderna nhập khẩu vào Việt Nam và đảm bảo an toàn, hiệu quả và chất lượng của lô vắc-xin Moderna nhập khẩu vào Việt Nam; Phối hợp với đơn vị phân phối, sử dụng vắc-xin Moderna triển khai hệ thống cảnh giác dược toàn diện đối với vắc-xin này tại Việt Nam theo quy định của pháp luật;
Bộ Y tế yêu cầu Chi nhánh Công ty TNHH Zuellig Pharma Việt Nam phối hợp với Cục Khoa học công nghệ và Đào tạo và đơn vị có đủ điều kiện tổ chức thực hiện việc đánh giá tính an toàn, hiệu quả của vắc-xin Moderna trên cơ sở ý kiến tư vấn của Hội đồng tư vấn sử dụng vắc-xin, sinh phẩm y tế của Bộ Y tế trong quá trình sử dụng;
Phối hợp với Viện Kiểm định Quốc gia vắc-xin và sinh phẩm y tế trong việc kiểm định các lô vắc-xin Moderna trước khi đưa ra sử dụng; phối hợp với Cục Y tế dự phòng hướng dẫn việc bảo quản, phân phối và sử dụng vắc-xin Moderna cho các cơ sơ tiêm chủng.
Ngoài ra, Bộ Y tế cũng yêu cầu Chi nhánh Công ty TNHH Zuellig Pharma Việt Nam phải phối hợp với Bộ Y tế Việt Nam để triển khai quản trị rủi ro đối với vắc-xin Moderna trong suốt quá trình lưu hành tại Việt Nam. Đồng thời, việc sử dụng vắc-xin Moderna phải theo hướng dẫn của Bộ Y tế Việt Nam.
Về phía cơ quan quản lý nhà nước, Bộ Y tế yêu cầu Cục Quản lý Dược có trách nhiệm cấp phép nhập khẩu vắc-xin Moderna theo quy định tại Điều 67 Nghị định 54/2017/NĐ-CP.
Cục Khoa học công nghệ và Đào tạo có trách nhiệm lựa chọn đơn vị có đủ điều kiện đánh giá tính an toàn, hiệu quả của vắc-xin trên cơ sở ý kiến tư vấn của Hội đồng tư vấn sử dụng vắc-xin, sinh phẩm y tế của Bộ Y tế.
Cục Y tế Dự phòng thực hiện các trách nhiệm liên quan đến tiêm chủng vắc-xin Moderna theo quy định. Viện Kiểm định Quốc gia vắc-xin và sinh phẩm y tế có trách nhiệm tiến hành kiểm định và cấp Giấy chứng nhận xuất xưởng lô vắc-xin Moderna trước khi đưa ra sử dụng.
Theo các chuyên gia, hiệu quả của vắc-xin Moderna trong nghiên cứu được đánh giá bằng tiêu chí giảm tỷ lệ bệnh nhân mắc Covid-19 có triệu chứng (tính từ thời điểm 14 ngày sau khi hoàn thành liều tiêm thứ 2).
Nghiên cứu trên 28.207 bệnh nhân (độ tuổi từ 18 đến 94) cho thấy vắc-xin Moderna có hiệu quả giảm 94.1% nguy cơ mắc Covid-19 có triệu chứng.
Các tác dụng không mong muốn thường hay xuất hiện hơn sau liều tiêm thứ 2. Theo đó, các phản ứng phụ này thường có mức độ từ nhẹ đến trung bình và các triệu chứng thường cải thiện sau khoảng 2 - 3 ngày sau tiêm vắc-xin. Các tác dụng không mong muốn thường gặp nhất bao gồm: Đau vị trí tiêm (92.0%); Mệt mỏi (70.0%); Đau đầu (64.7%); Đau cơ, khớp (~ 50%); Nôn, buồn nôn (23.0%); Sốt (15.5%)
Tỷ lệ xảy ra phản ứng sốc phản vệ (nguy cơ đe dọa tính mạng) sau tiêm vắc-xin được ghi nhận là 2.8 ca/1 triệu liều.
Đối tượng cần cẩn trọng khi tiêm vắc-xin Moderna là người có tiền sử phản ứng dị ứng nghiêm trọng (như phản vệ) với liều vaccin mRNA Covid-19 trước đó.
Có tiền sử phản ứng quá mẫn (bao gồm các triệu chứng mày đay cấp tính, phù mạch, suy hô hấp, phản vệ trong vòng 4 giờ sau tiêm với polyethylene glycol (PEG) hoặc polysorbate
Ngoài ra, cần chú ý thận trọng khi tiêm vắc-xin Moderna nếu bệnh nhân đang có các bệnh lý cấp tính mức độ trung bình đến nặng hoặc có tiền sử quá mẫn với các vắc-xin khác hoặc các thuốc khác. Các trường hợp này nếu cần tiêm vắc-xin cần xin ý kiến của chuyên gia miễn dịch-dị ứng.
Vắc-xin Moderna được chỉ định tiêm bắp liều 0.5 ml (chứa 100 μg of mRNA-1273). Tiêm tổng cộng 2 liều, mỗi liều tiêm cách nhau tối thiểu 28 ngày.
Về quá trình nghiên cứu, sản xuất vắc-xin Moderna
Tháng 1/2020, Moderna bắt đầu nghiên cứu vắc-xin coronavirus.
Ngày 16/3, các nhà khoa học Moderna lần đầu tiên thử nghiệm vắc-xin Covid-19 trên người.
Ngày16/4, Moderna thông báo rằng chính phủ Hoa Kỳ sẽ cung cấp 483 triệu đô la hỗ trợ cho việc phát triển và thử nghiệm vắc xin của Moderna. Các nhà nghiên cứu của Viện Y tế Quốc gia sẽ giám sát phần lớn nghiên cứu, bao gồm việc thử nghiệm lâm sàng.
Ngày 27/7, Sau khi các nghiên cứu ban đầu mang lại kết quả đầy hứa hẹn, Moderna và N.I.H. bắt đầu thử nghiệm Giai đoạn 3 trên 30.000 tình nguyện viên ở khắp Hoa Kỳ. Trong đó 1/4 số người tham gia là từ 65 tuổi trở lên.
Ngày 28/7, Moderna phát hiện rằng vắc-xin có thể chống coronavirus ở khỉ.
Ngày 11/8, Chính phủ Hoa Kỳ thưởng cho công ty thêm 1,5 tỷ đô la để đổi lấy 100 triệu liều, nếu vắc xin được Cục Quản lý Thực phẩm và Dược phẩm cấp phép.
Ngày 16/11, Moderna công bố dữ liệu sơ bộ về kết quả thử nghiệm giai đoạn 3. Các nhà nghiên cứu ước tính rằng vắc-xin có thể đạt hiệu quả đến 94,1%, cao hơn nhiều so với dự kiến của các chuyên gia khi bắt đầu thử nghiệm vắc-xin.
Ngày 30/11, Moderna xin cấp phép sử dụng khẩn cấp từ F.D.A.
Ngày 2/12, Moderna đăng ký thử nghiệm vắc-xin trên trẻ em từ 12 đến 18 tuổi.
Ngày 18/12, F.D.A. cấp phép sử dụng vắc xin Moderna trong trường hợp khẩn cấp. Những mũi tiêm vắc xin đầu tiên bắt đầu vào ngày 21 tháng 12.
Ngày 23/12, Canada cấp phép sử dụng vắc xin.
Ngày 31/12, Công ty dự kiến sản xuất 20 triệu liều vào cuối năm nay và lên đến một tỷ liều vào năm 2021. Mỗi người tiêm chủng sẽ cần hai liều.
Ngày 4/1, Israel cấp phép sử dụng vắc xin trong trường hợp khẩn cấp.
-
Hơn 1.000 người bệnh ung thư về quê trên hành trình Chuyến xe yêu thương -
Hành trình IVF gian nan của cặp vợ chồng hiếm muộn đón cái Tết đầu tiên bên con thơ -
Tin mới y tế ngày 12/2: Hà Nội quyết tâm chặn, siết chặt phòng dịch dịp Tết Nguyên đán -
Bộ Y tế lên tiếng về việc từ chối thanh toán X-quang dưới 6 phút -
Đi khám dạ dày, phát hiện ung thư phổi hiếm từ một chỉ số bất thường -
GS.TS.BS Phạm Nhật An: Chuyên gia Nhi khoa đầu ngành và triết lý “chăm sóc trẻ không chỉ là chữa bệnh” -
Tết của người bệnh, Tết của những ca trực 24/24
-
1  Quy hoạch ổn định Cảng hàng không quốc tế Đà Nẵng với công suất 20 triệu hành khách/năm
Quy hoạch ổn định Cảng hàng không quốc tế Đà Nẵng với công suất 20 triệu hành khách/năm -
2  Đổi mới chính sách tài chính đất đai, khơi thông nguồn lực, giảm gánh nặng xã hội
Đổi mới chính sách tài chính đất đai, khơi thông nguồn lực, giảm gánh nặng xã hội -
3  Cục Đường bộ Việt Nam thông tin về các trạm dừng nghỉ trên cao tốc Bắc - Nam
Cục Đường bộ Việt Nam thông tin về các trạm dừng nghỉ trên cao tốc Bắc - Nam -
4  Được giảm 50% dự trữ bắt buộc, 4 nhà băng có thêm hàng chục nghìn tỷ đồng để cho vay
Được giảm 50% dự trữ bắt buộc, 4 nhà băng có thêm hàng chục nghìn tỷ đồng để cho vay
-
 Agribank triển khai đồng bộ các giải pháp thúc đẩy tài chính toàn diện
Agribank triển khai đồng bộ các giải pháp thúc đẩy tài chính toàn diện -
 Khánh thành, thông xe công trình cầu vượt Thanh Hà
Khánh thành, thông xe công trình cầu vượt Thanh Hà -
 SATRA khai mạc chợ hoa xuân Bình Điền Bính Ngọ
SATRA khai mạc chợ hoa xuân Bình Điền Bính Ngọ -
 Techcombank Private: Kiến tạo tương lai quản lý gia sản tại Việt Nam
Techcombank Private: Kiến tạo tương lai quản lý gia sản tại Việt Nam -
 Vì sao nên sử dụng giải pháp vay kinh doanh của ngân hàng VietinBank?
Vì sao nên sử dụng giải pháp vay kinh doanh của ngân hàng VietinBank? -
 Nutifood sở hữu dây chuyền sữa công thức pha sẵn đầu tiên tại Việt Nam đạt chứng nhận hữu cơ Úc (ACO)
Nutifood sở hữu dây chuyền sữa công thức pha sẵn đầu tiên tại Việt Nam đạt chứng nhận hữu cơ Úc (ACO)