 Cả nhà nhập viện vì cúm mùa sau Tết
Cả nhà nhập viện vì cúm mùa sau Tết -
 Cả nhà nhập viện vì cúm mùa sau Tết
Cả nhà nhập viện vì cúm mùa sau Tết -
 Phòng chống bệnh lý hô hấp khi thời tiết giao mùa Đông- Xuân
Phòng chống bệnh lý hô hấp khi thời tiết giao mùa Đông- Xuân -
 Tin mới y tế ngày 28/2: Y tế gia đình - Mảnh ghép còn thiếu trong hệ thống chăm sóc sức khỏe
Tin mới y tế ngày 28/2: Y tế gia đình - Mảnh ghép còn thiếu trong hệ thống chăm sóc sức khỏe -
 Cúm mùa gia tăng, đừng chờ biến chứng mới đi tiêm
Cúm mùa gia tăng, đừng chờ biến chứng mới đi tiêm -
Bộ Y tế đề xuất cấm trưng bày thuốc lá dưới mọi hình thức -
BSCKII. Nguyễn Đình Tuấn: Giúp bệnh nhân phục hồi các chức năng thần kinh, đó là niềm hạnh phúc rất đặc biệt
Nguyên nhân chính là do những thủ tục hành chính cũng như nhiều quy định trong nước chưa đồng nhất khiến nhà đầu tư “nản”.
Khó có hệ thống!
Việt Nam hiện thuộc nhóm quốc gia có tổng giá trị thị trường dược phẩm và mức tăng trưởng ngành dược nhanh nhất thế giới. Được biết, hiện tổng giá trị thị trường dược phẩm tại Việt Nam đạt 2,7 tỉ USD trong năm 2015, tăng lên 5,1 tỉ USD năm 2018 và năm 2020 đạt 6,1 tỉ USD.
 |
| Ông Tạ Mạnh Hùng phát biểu tại Hội thảo. |
Theo phân loại của Tổ chức Y tế Thế giới (WHO), ngành công nghiệp dược Việt Nam ở cấp độ 3 (cấp có ngành công nghiệp dược nội địa, có sản xuất thuốc generic, xuất khẩu được một số dược phẩm).
Ngành công nghiệp dược Việt Nam đặt mục tiêu tăng sản xuất thuốc nội địa để chiếm lĩnh 80% thị trường dược phẩm trong nước, so với 50% hiện nay.
Thông tin về năng lực sản xuất dược phẩm của Việt Nam, ông Tạ Mạnh Hùng, Phó Cục trưởng Cục Quản lý Dược, Bộ Y tế, hiện Việt Nam có 228 đơn vị sản xuất dược phẩm đạt tiêu chuẩn GMP-WHO;
Trong số 25.000 loại thuốc đang được cấp phép lưu hành trong toàn quốc do đơn vị trong nước sản xuất có hàm lượng khoa học công nghệ không cao, chữa các bệnh lý thông thường, bệnh lý thể nhẹ. Ngoài ra, 90% nguyên liệu sản xuất thuốc trong nước vẫn phải nhập khẩu.
Bên cạnh đó, việc chuyển giao công nghệ trong công nghiệp dược gần như không có; tỉ lệ gia công cho nước ngoài rất ít ỏi và hiện chủ yếu là gia công cho các doanh nghiệp trong nước.
Để thúc đẩy sản xuất kinh doanh dược phẩm, theo lãnh đạo Cục Quản lý Dược, thời gian qua cơ quan này đã rà soát báo cáo Thủ tướng các quy định ưu đãi đầu tư đối với hoạt động sản xuất thuốc, vắc-xin sinh phẩm, vật tư y tế.
Đồng thời, đề xuất thực hiện một số nội dung về xây dựng chính sách khuyến khích, ưu đãi đầu tư, sản xuất thuốc, vắc-xin sinh phẩm. Bộ Y tế cũng đề xuất giao Bộ Tài chính sửa đổi chính sách ưu đãi thuế thu nhập doanh nghiệp;
Bên cạnh đó, Bộ Y tế cũng đề xuất đưa hoạt động sản xuất thuốc, vắc-xin sinh phẩm vào danh mục chi tiết các loại hình tiêu chí, quy mô, tiêu chuẩn của các cơ sở thực hiện xã hội hóa ban hành kèm theo Quyết định số 1466/QĐ-TTgngày 10/10/2008 của Thủ tướng Chính phủ để làm cơ sở áp dụng chính sách ưu đãi thuế thu nhập doanh nghiệp trong lĩnh vực.
Bộ Y tế cũng làm việc với UBND và các khu công nghiệp để bố trí các khu công nghiệp dược nhằm thu hút đầu tư, đồng thời dự kiến tổ chức Hội nghị đầu tư trong lĩnh vực Dược. Ngoài ra, còn rà soát sửa đổi nội dung của Luật Dược về phát triển công nghiệp dược;
Dù đã có nhiều nỗ lực song theo thừa nhận của lãnh đạo Cục Quản lý Dược, hiện chính sách ưu đãi, thu hút đầu tư đối với sản xuất thuốc, vắc-xin và sinh phẩm y tế còn chưa đủ hấp dẫn các nhà đầu tư nước ngoài, chưa thu hút nguồn đầu tư phát triển dược liệu.
Bên cạnh đó, chính sách quản lý giá thuốc, định hướng sử dụng thuốc generic... hạn chế việc chuyển giao công nghệ sản xuất thuốc mới, thuốc biệt dược.
Hệ thống văn bản quy phạm pháp luật còn nhiều nội dung chưa được điều chỉnh, bổ sung, sửa đổi để phù hợp, đáp ứng yêu cầu quản lý trong xu thế quản lý hiện nay.
Chưa kể, quy định về bảo vệ sở hữu trí tuệ, chống hàng giả, hàng nhái còn nhiều bất cập gây lo ngại cho các cơ sở sản xuất và các nhà đầu tư nước ngoài.
Các Dự án phát triển dược liệu triển khai chậm. Năng lực quản lý, khai thác nguồn dược liệu quý hiếm, đặc hữu chưa được chú trọng.
Vấn đề liên kết giữa doanh nghiệp và chính quyền địa phương/nông dân còn chưa chặt chẽ, chưa tạo ra sự ổn định về đầu ra cho dược liệu.
Về phía doanh nghiệp, theo bà Ju Eunice Cho, Tổng giám đốc Tập đoàn Viatris, các doanh nghiệp 100% vốn nước ngoài bị hạn chế trong việc nhận lại hoặc mua các sản phẩm thuốc nội địa hoá thông qua gia công, chuyển giao công nghệ từ đối tác sản xuất tại Vietnam và bán cho nhà phân phối trong nước.
Thay vào đó, các công ty này phải đợi các đối tác xuất khẩu thuốc ra nước ngoài rồi nhập lại. Điều này làm phát sinh chi phí và thời gian không cần thiết trong việc đưa thuốc ra thị trường và tới tay bệnh nhân. Do đó cũng làm giảm hiệu quả đầu tư cũng như tính hấp dẫn trong thu hút đầu tư nước ngoài của các Dự án chuyển giao công nghệ.
Còn theo bà Nguyễn Thu Thủy, Trưởng Văn phòng đại diện Hà Nội của Công ty Servier, doanh nghiệp đang có nhiều vướng mắc trong triển khai ưu đãi đầu tư với dự án.
Cụ thể, Quyết định số 376/QĐ-TTg ngày 17/03/2021 có quy định lộ trình giữ giá, giảm giá thuốc phát minh để thu hút doanh nghiệp chuyển giao công nghệ sản xuất thuốc phát minh tại Việt Nam. Tuy nhiên, đến thời điểm hiện tại vẫn chưa có văn bản quy phạm pháp luật quy định cụ thể ưu đãi này.
Việc áp dụng thực tế các quy định trong đàm phán giá cũng chưa thống nhất, chưa đảm bảo tính khuyến khích đối với các dự án chuyển giao công nghệ.
Đại diện của Công ty TNHH Medochemie (Viễn Đông) thì cho rằng, mỗi dự án chuyển giao công nghệ đều rất tốn kém và cần phải lập dự trù kinh phí chi tiết cho từng sản phẩm
Việc chuyển giao công nghệ tiêu tốn nhiều thời gian của các bộ phận trọng yếu, thời gian đào tạo cho nhân viên, và thời gian vận hành của thiết bị thay vì để sản xuất thương mại thì phải dành phục vụ cho sản phẩm chuyển giao công nghệ.
Về phía Tập đoàn dược phẩm Sanofi theo bà Nguyễn Thị Lương Phong, Giám đốc đối ngoại, từ sáng chế thuốc tới cấp phép, phát triển một dược phẩm mới mất thời gian từ 10 đến 15 năm, chi phí 2,6 tỉ đô. Như vậy, chỉ cần chậm chễ một khâu hoặc ách tắc ở đâu thiệt hại sẽ rất lớn cả về thời gian và chi phí.
Nói về khó khăn khi tiến hành chuyển giao công nghệ và đầu tư tại Việt Nam bà Nguyễn Thu Thủy ví von, Quyết định 376/QĐ-TTg của Thủ tướng Chính phủ là cứu cánh cho các doanh nghiệp khi có nhiều quy định thuận lợi, tạo điều kiện cho doanh nghiệp đầu tư, chuyển giao công nghệ tại Việt Nam.
Tuy nhiên, chỉ Quyết định 376/QĐ-TTg của Thủ tướng Chính phủ là chưa đủ, đây được coi như “nguyên liệu” nhằm sản xuất thuốc, nhưng từ nguyên liệu để thành thuốc đến tay người tiêu dùng thì còn cần rất nhiều yêu cầu khác, trong đó các văn bản hướng dẫn cụ thể là rất cần thiết.
Cởi trói ra sao?
Để khắc phục các hạn chế đang tồn tại liên quan tới công tác đầu tư, chuyển giao công nghệ sản xuất dược phẩm theo ông Tạ Mạnh Hùng, thời gian tới Bộ Y tế sẽ định định hướng các loại hình sản phẩm ưu tiên phát triển sản xuất trong nước cần có sự đầu tư về khoa học công nghệ như các dược liệu ưu tiên phát triển, các nguyên liệu hóa dược có khả năng cạnh tranh, các dạng bào chế tiên tiến hiện đại.
Nghiên cứu, đề xuất các chính sách ưu đãi cho khu công nghiệp dược/cơ sở sản xuất thuốc, vắc-xin, trong đó có việc chuyển giao công nghệ sản xuất thuốc gốc, vắc-xin sử dụng công nghệ cao, đáp ứng nhu cầu phòngchữa bệnh.
Trình Chính phủ xem xét, sửa đổi, bổ sung các quy định liên quan đến các chính sách ưu đãi. Xây dựng chính sách khuyến khích, hỗ trợ doanh nghiệp đầu tư phát triển sản phẩm chất lượng cao, sử dụng công nghệ cao để tăng cường khả năng cạnh tranh với sản phẩm nhập khẩu cùng loại và kêu gọi doanh nghiệp đầu tư theo hướng này
Tiến hành cải cách thủ tục liên quan đến công tác đăng ký thuốc, thử nghiệm lâm sàng, đánh giá tương đương sinh học của thuốc, công tác quản lý chất lượng thuốc, đấu tranh chống hàng giả, hàng lậu, khôngrõ nguồn gốc.
Đẩy mạnh tin học hóa công tác quản lý dược. Đặc biệt là sửa đổi, bổ sung Luật Dược và các văn bản hướng dẫn nhằm tạo hành lang pháp lý đầy đủ, thông thoáng cho hoạt động sản xuất, kinh doanh thuốc, vắc-xin, sinh phẩm;
Thu hút đầu tư nước ngoài/chuyển giao công nghệ sản xuất thuốc, vắc-xin, sinh phẩm từ các nước có ngành dược tiên tiến. Tiếp tục làm việc với các địa phương để triển khai xây dựng các đề án Khu công nghiệp.
Ưu tiên về quỹ đất cho xây dựng các nhà máy, khu công nghiệp dược, các trung tâm nghiên cứu, thử nghiệm dược phẩm, ưu tiên bố trí giao đất, giao rừng cho các dự án phát triển dược liệu.
Về phía Bộ Khoa học và Công nghệ, ông Phạm Hồng Quất, Cục trưởng Cục Phát triển thị trường và doanh nghiệp khoa học công nghệ cho rằng, chính sách khuyến khích, ưu đãi cho doanh nghiệp trong nước nhận chuyển giao công nghệ sản xuất thuốc phát minh (theo sáng chế đã được cấp bằng độc quyền) đã có quy định nhưng cần được triển khai trong thực tế.
Đặc biệt, cần có hướng dẫn cụ thể về điều kiện đối với doanh nghiệp được tiếp nhận chuyển giao công nghệ và điều kiện được hưởng các ưu đãi để thực sự “hấp dẫn các doanh nghiệp chuyển giao công nghệ sản xuất thuốc phát minh tại Việt Nam” như mục tiêu ghi trong Quyết định số 376/QĐTTg.
Một số ý kiến tại Hội nghị cũng kiến nghị các giải pháp thúc đẩy ngành công nghiệp dược phẩm phát triển là Bộ kế hoạch và Đầu tư cần tạo điều kiện để các doanh nghiệp sản xuất thuốc phát minh (được bảo hộ sáng chế) được hưởng các ưu đãi như doanh nghiệp công nghệ cao; sản phẩm thuốc phát minh được coi là sản phẩm công nghệ cao;
Có lộ trình giảm giá thuốc phát minh phù hợp hấp dẫn các doanh nghiệp chuyển giao công nghệ sản xuất thuốc phát minh tại Việt Nam; tăng tỷ lệ trích quỹ R&D đối với doanh nghiệp dược đầu tư vào nghiên cứu, phát triển thuốc mới.
Với những khó khăn đang gặp phải, đại diện Viatris đề xuất, với các thuốc biệt dược gốc trước chuyển giao công nghệ đã được Bộ Khoa học và Công nghệ cấp giấy chứng nhận đăng ký chuyển giao công nghệ thì việc chấm điểm hạ mức độ giảm giá trong đàm phán giá cần được tuân thủ theo đúng bộ tiêu chí đàm phán giá.
Có quyết định được gia công phối hợp chuyển giao công nghệ tại Việt Nam và có báo cáo triển khai theo đúng tiến độ, hoàn thiện trong năm thực hiện đàm phán cũng như các quy định trong Thông tư 15/2020.
Đối với các thuốc sau gia công, chuyển giao công nghệ sản xuất tại Việt Nam cần có một cơ chế mua sắm ưu đãi đặc biệt, bao gồm cả đấu thầu tập trung cấp quốc gia đi kèm với ưu đãi về số lượng.
Đặc biệt, cần xem xét điều chỉnh các quy định liên quan để các doanh nghiệp nước ngoài FIE có thể trực tiếp nhận lại, mua lại thuốc gia công, chuyển giao công nghệ từ đối tác Việt Nam, từ đó có thể đẩy nhanh sản xuất và góp phần sớm hiện thực hoá mục tiêu mà Quyết định 376 đề ra.
Ngoài ra, cần xây dựng thêm các cơ chế ưu đãi về thuế cho doanh nghiệp nước ngoài làm chuyển giao công nghệ trong lĩnh vực Dược phẩm.
Quyết định 376/QĐ-TTg của Thủ tướng Chính phủ về chương trình phát triển công nghiệp dược, dược liệu sản xuất trong nước giai đoạn 2030-2045, đặt mục tiêu đến năm 2025 thuốc sản xuất trong nước đạt 75% số lượng sử dụng và 60% giá trị thị trường, tỉ lệ sử dụng dược liệu nguồn gốc trong nước, thuốc dược liệu tăng thêm ít nhất 10% so với năm 2020.
Mục tiêu đến năm 2030, thuốc sản xuất trong nước đạt 80% số lượng sử dụng và 70% giá trị thị trường. Đồng thời, chuyển giao công nghệ sản xuất ít nhất 100 thuốc phát minh còn bản quyền, vắc-xin, sinh phẩm y tế và thuốc mà Việt Nam chưa sản xuất được. Trở thành trung tâm sản xuất dược phẩm giá trị cao trong khu vực. Phấn đấu giá trị xuất khẩu thuốc sản xuất trong nước đạt khoảng 1 tỉ USD.
Định hướng của Quyết định 376 cũng nêu rõ, giai đoạn 2030-2045 phải đạt việc người dân Việt Nam được dùng thuốc tốt do Việt Nam sản xuất và hướng đến cả xuất khẩu. Mục tiêu đến năm 2045, tổng giá trị ngành công nghiệp dược đóng góp vào GDP trên 20 tỉ USD.

-
BSCKII. Nguyễn Đình Tuấn: Giúp bệnh nhân phục hồi các chức năng thần kinh, đó là niềm hạnh phúc rất đặc biệt -
Trường Đại học Y Dược Thái Bình: Đẩy mạnh chuyển đổi số, xây dựng Đại học - Bệnh viện thông minh -
Bác sĩ nội trú trẻ chạm mốc hàng vạn ca nội soi mỗi năm, làm chủ kỹ thuật chẩn đoán, điều trị ung thư sớm không can thiệp -
ThS.BSNT Trương Quốc Thanh - Người "âm thầm” đảm bảo độ chính xác trong chẩn đoán bệnh lý ung thư tại MEDLATEC -
BSCKI. Trần Văn Thụ - Người “giải mã” những ẩn số dưới lớp phim đen trắng -
Kết nối học thuật và thực hành, nâng tầm y tế chuyên sâu -
Mở rộng danh mục bảo hiểm y tế, thêm 30 thuốc điều trị ung thư
-
1  Nghiên cứu mở rộng đối tượng được mua nhà ở xã hội; Đề xuất phát triển nhà ở thương mại giá phù hợp
Nghiên cứu mở rộng đối tượng được mua nhà ở xã hội; Đề xuất phát triển nhà ở thương mại giá phù hợp -
2  Khẩn trương xây dựng tiêu chí đánh giá năng lực cạnh tranh quốc tế Sân bay Long Thành
Khẩn trương xây dựng tiêu chí đánh giá năng lực cạnh tranh quốc tế Sân bay Long Thành -
3 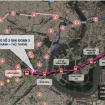 TP.HCM dự kiến khởi công tuyến metro Bến Thành - Thủ Thiêm trước 20/4
TP.HCM dự kiến khởi công tuyến metro Bến Thành - Thủ Thiêm trước 20/4 -
4  Tìm cơ hội để giành thị phần vốn đầu tư nước ngoài
Tìm cơ hội để giành thị phần vốn đầu tư nước ngoài
-
 Xổ số kiến thiết miền Nam đặt mục tiêu doanh thu gần 173 ngàn tỷ đồng trong năm 2026
Xổ số kiến thiết miền Nam đặt mục tiêu doanh thu gần 173 ngàn tỷ đồng trong năm 2026 -
 INTECH E&C vinh dự đồng hành triển khai nhà máy kiểm thử và đóng gói chip bán dẫn đầu tiên do người Việt làm chủ
INTECH E&C vinh dự đồng hành triển khai nhà máy kiểm thử và đóng gói chip bán dẫn đầu tiên do người Việt làm chủ -
 VietinBank năm 2025: Cải thiện hiệu quả, tăng trưởng bền vững
VietinBank năm 2025: Cải thiện hiệu quả, tăng trưởng bền vững -
 EVNGENCO1 bứt phá trong thách thức
EVNGENCO1 bứt phá trong thách thức -
 Mảnh ghép cuối cùng của lõi CBD Sài Gòn: One Central Saigon và câu chuyện tái định vị trung tâm Quận 1
Mảnh ghép cuối cùng của lõi CBD Sài Gòn: One Central Saigon và câu chuyện tái định vị trung tâm Quận 1 -
 Phú Gia Group ra mắt thương hiệu Tập đoàn - công bố chiến lược 2026 và bổ nhiệm đội ngũ lãnh đạo cấp cao
Phú Gia Group ra mắt thương hiệu Tập đoàn - công bố chiến lược 2026 và bổ nhiệm đội ngũ lãnh đạo cấp cao










