Tăng năng lực kiểm nghiệm thực phẩm, nâng chuẩn bảo vệ bữa ăn người Việt
Tăng năng lực kiểm nghiệm thực phẩm, nâng chuẩn bảo vệ bữa ăn người Việt -
 Tăng năng lực kiểm nghiệm thực phẩm, nâng chuẩn bảo vệ bữa ăn người Việt
Tăng năng lực kiểm nghiệm thực phẩm, nâng chuẩn bảo vệ bữa ăn người Việt -
 Phụ nữ sau 40 tuổi cần cảnh giác ung thư buồng trứng
Phụ nữ sau 40 tuổi cần cảnh giác ung thư buồng trứng -
 Tin mới y tế ngày 8/2: Ngộ độc khí CO mùa lạnh và những cảnh báo quan trọng của bác sỹ
Tin mới y tế ngày 8/2: Ngộ độc khí CO mùa lạnh và những cảnh báo quan trọng của bác sỹ -
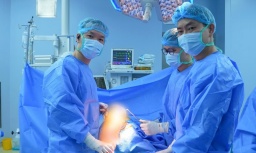
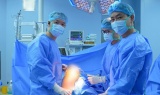 Thay khớp gối chất lượng cao giúp người bệnh không phải ra nước ngoài
Thay khớp gối chất lượng cao giúp người bệnh không phải ra nước ngoài -
Bảo hiểm y tế chi trả chẩn đoán hình ảnh không phim -
Không để vi rút Nipah xâm nhập qua cửa khẩu dịp Tết
Theo đó, Bộ Y tế đề nghị Sở Y tế khẩn trương ban hành văn bản đề nghị cơ sở sản xuất, mua bán, xuất nhập khẩu trang thiết bị y tế trên địa bàn rà soát lại các hồ sơ công bố trang thiết bị y tế trên hệ thống dịch vụ công trực tuyến quản lý trang thiết bị y tế theo đúng quy định pháp luật, trong đó lưu ý rà soát kết quả phân loại trang thiết bị y tế bảo đảm theo đúng quy định về phân loại trang thiết bị y tế;
Kiểm tra về tính hợp pháp, chính xác của các giấy tờ, tài liệu đã nộp trong hồ sơ và bảo đảm các giấy tờ, tài liệu của hồ sơ luôn còn hiệu lực trong suốt quá trình thực hiện, đồng thời chịu trách nhiệm lưu giữ các giấy tờ, tài liệu trong hồ sơ đã nộp theo quy định.
 |
| Bộ Y tế vừa có văn bản gửi Sở Y tế các tỉnh, thành phố trong cả nước về việc kiểm tra, rà soát thủ tục công bố trang thiết bị y tế, chấn chỉnh kịp thời và xử lý nếu có vi phạm. |
Bộ Y tế đề nghị Sở Y tế các tỉnh, thành phố khẩn trương tổ chức thanh, kiểm tra, hậu kiểm việc thực hiện đối với thủ tục công bố tiêu chuẩn áp dụng đối với trang thiết bị y tế thuộc loại A, B và thực hiện thu hồi số công bố theo quy định… và báo cáo kết quả về Bộ.
Trước đó, qua tìm hiểu phóng viên, theo quy định tại Nghị định số 98/2021/NĐ-CP về quản lý trang thiết bị y tế, tùy theo mức độ rủi ro khi sử dụng, trang thiết bị y tế được chia thành 4 nhóm A (mức độ rủi ro thấp), B (mức độ rủi ro trung bình thấp), C (mức độ rủi ro trung bình cao), D (mức độ rủi ro cao).
Trước khi đưa trang thiết bị y tế thuộc nhóm A, B lưu thông trên thị trường, doanh nghiệp tự công bố với sở y tế nơi đặt trụ sở kinh doanh, sau đó sở y tế thực hiện hậu kiểm.
Trong khi đó, nhóm C và D phải được Bộ Y tế cấp phép số đăng ký lưu hành với quy trình kiểm soát nghiêm ngặt và mất nhiều thời gian hơn.
Theo phản ánh của nhiều doanh nghiệp, ngày càng có nhiều nhà thầu kê khai trang thiết bị y tế có mức độ rủi ro thấp (A và B), trong khi đây là đối tượng thuộc nhóm C và D, để dễ dàng tham dự và trúng thầu.
Tại Công văn số 2098/BYT-TB-CT ngày 12/4/2023, Bộ Y tế yêu cầu các sở y tế tăng cường rà soát, kiểm tra hồ sơ công bố tiêu chuẩn áp dụng đối với trang thiết bị y tế loại A, B để kịp thời chấn chỉnh và xử lý vi phạm đối với những sản phẩm trang thiết bị y tế chẩn đoán in vitro (IVD) được phân loại trang thiết bị y tế thuộc loại A hoặc B, nhưng mục đích sử dụng của sản phẩm không phù hợp.
Cụ thể là IVD có mục đích sử dụng để xác định nhóm máu, xét nghiệm tại chỗ thông số đường huyết, xét nghiệm HIV, xét nghiệm viêm gan B (HBV), xét nghiệm viêm gan C (HCV), xét nghiệm virus Dengue (sốt xuất huyết), xét nghiệm virus cúm A/B (Influenza A, B), theo dõi nồng độ các chất hoặc các thành phần sinh học mà kết quả xét nghiệm sai có thể đe dọa tính mạng bệnh nhân ngay tức thì do quyết định điều trị không phù hợp…
Mặc dù vậy, cho đến nay, số lượng trang thiết bị y tế có kết quả phân loại sai mức độ rủi ro bị thu hồi rất khiêm tốn.
Tình trạng kê khai sai mức độ rủi ro không chỉ xảy ra giữa các sản phẩm trang thiết bị y tế, mà theo Bộ Y tế, thực tế còn có tình trạng doanh nghiệp đánh tráo sản phẩm có chứa dược chất đánh dấu Urea C13 và Urea C14 dưới dạng uống kèm theo bộ xét nghiệm, máy xét nghiệm vi khuẩn Helicobacter Pylori bằng hình thức xin cấp phép nhập khẩu trang thiết bị y tế hoặc công bố là trang thiết bị y tế loại A.
Trong khi đó, các sản phẩm có chứa dược chất này phải đăng ký lưu hành và quản lý theo quy định về quản lý thuốc tại cơ quan quản lý dược tham chiếu trên thế giới như US-FDA, EMA… và được phân loại trong nhóm thuốc chẩn đoán theo hệ thống phân loại ATC của Tổ chức Y tế Thế giới (WHO).
Theo khuyến cáo của nhiều chuyên gia y tế, nếu phân loại không chuẩn xác, trang thiết bị y tế thuộc nhóm C, D mà kê khai nhóm A, B, hay sản phẩm có dược chất trà trộn vào trang thiết bị y tế để tránh kiểm soát của cơ quan quản lý nhà nước sẽ rất nguy hiểm cho người sử dụng.
Ví dụ, test Troponin I trong chẩn đoán nhồi máu cơ tim là xét nghiệm cấp cứu, tức là có mức độ rủi ro cao nhất, ảnh hưởng đến chất lượng xét nghiệm.
Chỉ cần sản phẩm xét nghiệm không được kiểm soát nghiêm ngặt, cho kết quả âm tính thì sẽ ảnh hưởng tới tính mạng của người bệnh, bỏ lỡ cơ hội được cứu sống.
Mặc dù rất lo lắng về chất lượng sản phẩm trúng thầu khi đưa vào sử dụng, nhưng một số đơn vị mua sắm cho biết không thể loại những sản phẩm phân loại sai vì mẫu hồ sơ mời thầu hiện không có quy định nào đánh giá tư cách hợp lệ của các hàng hóa dự thầu.
Bên mời thầu và người sử dụng bị rơi vào tình thế đã xong, chỉ có thể xử lý nhà thầu trúng thầu bằng cách tịch thu bảo đảm thực hiện hợp đồng sau khi sản phẩm đó bị Sở Y tế ra quyết định thu hồi số công bố trong quá trình hậu kiểm vì kê khai không trung thực nhóm trang thiết bị y tế.
Một số nhà thầu khi được hỏi khá lo ngại về sự trà trộn của những nhà thầu làm ăn chộp giật tạo môi trường cạnh tranh thiếu lành mạnh trong đấu thầu, bất công cho nhà thầu làm ăn chân chính, tuân thủ đúng quy định của pháp luật.
Để kiểm soát chất lượng đầu vào của trang thiết bị y tế trúng thầu cũng như đảm bảo môi trường cạnh tranh lành mạnh, một cán bộ phụ trách công tác đấu thầu của một sở y tế đề xuất, Bộ Y tế và các cơ quan chức năng cần sớm khắc phục kẽ hở này bằng cách bổ sung quy định về tư cách hợp lệ của hàng hoá dự thầu với hàng rào kỹ thuật cụ thể trong hồ sơ mời thầu, yêu cầu các bên mời thầu kiểm soát chặt trong quá trình đánh giá hồ sơ dự thầu.
Đồng thời, tăng cường hậu kiểm, thu hồi kết quả phân loại sai trang thiết bị y tế, đánh giá uy tín của nhà thầu trong quá trình tham dự thầu cũng như các giải pháp kiểm soát khác.
Thiết nghĩ, trang thiết bị y tế có tính chất đặc thù, thường chứa đựng công nghệ có tính độc quyền, ít nhà cung cấp, gắn trực tiếp tới sức khoẻ và tính mạng của người bệnh nên cần kiểm soát chặt chẽ.
Theo các chuyên gia, yếu tố tác động đến chất lượng của thiết bị y tế trong đấu thầu là công năng sử dụng, chế độ bảo hành, bảo trì, lắp đặt, vận hành và giá cả, tiếp đến là năng lực tài chính, năng lực thực hiện, đảm đương dự án của doanh nghiệp; sau nữa, là kỹ sư, kỹ thuật viên tham gia vào các gói thầu.
-
Bảo hiểm y tế chi trả chẩn đoán hình ảnh không phim -
Không để vi rút Nipah xâm nhập qua cửa khẩu dịp Tết -
Tin mới y tế ngày 7/2: Ứng dụng công nghệ hiện đại vào phòng ngừa và quản lý sa sút trí tuệ ở người cao tuổi -
Bệnh thận mạn và lời khuyên dinh dưỡng từ bữa ăn ngày Tết -
Dự án Bệnh viện Bạch Mai, Việt Đức cơ sở 2 dồn lực hoàn thiện để sớm đón tiếp bệnh nhân -
Tin mới y tế ngày 6/2: Nhiễm vi khuẩn kháng thuốc sau khi mắc thủy đậu -
Hà Nội thu hút bác sỹ, chuyên gia giỏi với gói hỗ trợ lên tới hơn 5 tỷ đồng
-
1  EVN muốn vào Top 500 thế giới; Viettel bắt tay Nvidia; Petrolimex đổi nhận diện thương hiệu
EVN muốn vào Top 500 thế giới; Viettel bắt tay Nvidia; Petrolimex đổi nhận diện thương hiệu -
2  Đánh giá tác động của hầm đường bộ 2.500 tỷ đồng; Duyệt chủ trương đầu tư khu đô thị 17.785 tỷ đồng
Đánh giá tác động của hầm đường bộ 2.500 tỷ đồng; Duyệt chủ trương đầu tư khu đô thị 17.785 tỷ đồng -
3  Hà Nội khởi công 2 khu đô thị đa mục tiêu tổng 1.400 ha; "sổ đỏ" đã được tích hợp trên VNeID
Hà Nội khởi công 2 khu đô thị đa mục tiêu tổng 1.400 ha; "sổ đỏ" đã được tích hợp trên VNeID -
4  Đo bước tiến tại siêu dự án đường sắt tốc độ cao Bắc – Nam
Đo bước tiến tại siêu dự án đường sắt tốc độ cao Bắc – Nam
-
 Công ty Tân Đệ: Hàng trăm tỷ đồng đầu tư cho con người và hạ tầng sản xuất
Công ty Tân Đệ: Hàng trăm tỷ đồng đầu tư cho con người và hạ tầng sản xuất -
Panasonic công bố Nghiên cứu mới về công nghệ nanoe™ X thế hệ 3 ức chế 90% độc tố từ nấm mốc trong 5 phút
-
 Địa kỹ thuật Đông Sơn: Khẳng định vị thế qua những công trình hạ tầng trọng điểm
Địa kỹ thuật Đông Sơn: Khẳng định vị thế qua những công trình hạ tầng trọng điểm -
 Nhu cầu tham gia bảo hiểm để bảo vệ tài chính vẫn tiếp tục gia tăng
Nhu cầu tham gia bảo hiểm để bảo vệ tài chính vẫn tiếp tục gia tăng -
 First Real đạt tổng doanh thu hơn 20 tỷ đồng trong quý I/2026
First Real đạt tổng doanh thu hơn 20 tỷ đồng trong quý I/2026 -
 Bitexco Nam Long: Giữ vững sản xuất, hướng tới tăng trưởng bền vững
Bitexco Nam Long: Giữ vững sản xuất, hướng tới tăng trưởng bền vững