 Siết chặt “lá chắn” phòng dịch tại cửa khẩu, bệnh viện và cộng đồng
Siết chặt “lá chắn” phòng dịch tại cửa khẩu, bệnh viện và cộng đồng -
 Siết chặt “lá chắn” phòng dịch tại cửa khẩu, bệnh viện và cộng đồng
Siết chặt “lá chắn” phòng dịch tại cửa khẩu, bệnh viện và cộng đồng -
 Tin mới y tế ngày 17/2: Chào đón các công dân nhí của năm Bính Ngọ
Tin mới y tế ngày 17/2: Chào đón các công dân nhí của năm Bính Ngọ -
 Cảnh báo nguy cơ ngộ độc từ rượu giả, thực phẩm bẩn dịp Tết
Cảnh báo nguy cơ ngộ độc từ rượu giả, thực phẩm bẩn dịp Tết -
 Giao thừa cận kề, bệnh viện vẫn “trực chiến” giành giật sự sống cho bệnh nhân
Giao thừa cận kề, bệnh viện vẫn “trực chiến” giành giật sự sống cho bệnh nhân -
Tin mới y tế ngày 16/2: Các bệnh lý tai mũi họng dễ bùng phát dịp Tết Nguyên đán -
Nghi ngộ độc sau ăn bánh mỳ, Bộ Y tế yêu cầu khẩn trương truy xuất nguồn gốc
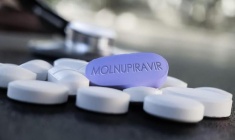
Cục Quản lý Dược, Bộ Y tế ban hành Quyết định số 69/QĐ-QLD về việc cấp phép cho 3 loại thuốc chứa Molnupiravir được sản xuất trong nước, phục vụ công tác phòng, chống dịch Covid-19. Việc cấp phép cho các loại thuốc này có hiệu lực 3 năm từ ngày ký ban hành quyết định.
| Cục Quản lý Dược, Bộ Y tế đã cấp phép cho 3 loại thuốc chứa Molnupiravir được sản xuất trong nước, phục vụ công tác phòng, chống dịch Covid-19. |
Theo đó, 3 loại thuốc được Cục Quản lý Dược cấp phép, bao gồm: Molravir 400: Hàm lượng Molnupiravir 400mg, dạng viên nang cứng, tuổi thọ 6 tháng, do Công ty cổ phần Dược phẩm Boston Việt Nam sản xuất;
Movinavir: Hàm lượng 200mg Molnupiravir, dạng viên nang cứng, tuổi thọ 6 tháng, do Công ty Cổ phần Hóa dược phẩm Mekophar sản xuất;
Molnuporavir Stella 400: Hàm lượng 400mg Molnupiravir, dạng viên nang cứng, tuổi thọ 8 tháng, do Công ty TNHH Liên doanh Stellapharm - chi nhánh 1 sản xuất.
Cục Quản lý Dược yêu cầu các cơ sở sản xuất và cơ sở đăng ký thuốc sản xuất phối hợp với các cơ sở điều trị thực hiện đúng các quy định hiện hành về thuốc kê đơn, theo dõi an toàn, hiệu quả, tác dụng không mong muốn của thuốc trên người Việt Nam và tổng hợp, báo cáo theo quy định.
Ngoài ra, Cục Quản lý Dược cũng đề nghị, Sở Y tế các tỉnh, thành phố trực thuộc Trung ương thông báo cho cơ sở khám, chữa bệnh, các cán bộ y tế, cơ sở cung ứng thuốc trên địa bàn thông báo cho bệnh nhân về các lợi ích, rủi ro khi sử dụng thuốc, các phương pháp điều trị, các thuốc khác có thể thay thế Molnupiravir trong điều trị Covid-19.
Cùng với đó, tăng cường theo dõi, giám sát, phát hiện các trường hợp xảy ra phản ứng có hại của thuốc (nếu có), gửi báo cáo về Trung tâm quốc gia về thông tin thuốc và theo dõi phản ứng có hại của thuốc (Hà Nội) hoặc Trung tâm khu vực về thông tin thuốc và theo dõi phản ứng có hại của thuốc TP.HCM) theo quy định.
Theo Cục Quản lý Dược, trách nhiệm của cơ sở sản xuất và cơ sở đăng ký phải thực hiện kiểm tra chất lượng nguyên liệu theo tiêu chuẩn nhà sản xuất và phải đạt yêu cầu mới được đưa vào sản xuất, đồng thời thực hiện việc lấy mẫu kiểm tra chất lượng theo tiêu chuẩn; thực hiện theo dõi về chất lượng, an toàn, hiệu quả của thuốc khi đưa ra lưu hành trên thị trường.
Trong quá trình lưu hành thuốc, căn cứ vào việc theo dõi, cập nhật thông tin về độ an toàn, hiệu quả của 3 loại thuốc trên, Cục Quản lý dược có thể quyết định thu hồi giấy đăng ký lưu hành đã cấp này theo quy định của Luật Dược.
Vừa qua, Molnupiravir được thử nghiệm lâm sàng cho khoảng 80.000 bệnh nhân tại 51 tỉnh, thành phố trên cả nước.
Kết quả được Bộ Y tế công bố khi điều trị F0 trong cộng đồng, cho thấy Molnupiravir có tính an toàn cao, dung nạp tốt, hiệu quả rõ rệt về giảm tải lượng virus, giảm lây lan, giảm chuyển nặng, rút ngắn thời gian điều trị với tỷ lệ bệnh nhân có kết quả xét nghiệm RT-PCR sau 5 ngày âm tính; tỷ lệ chuyển nặng rất thấp từ 0,02%-0,06% và không có ca nào dẫn đến tử vong.
Bộ Y tế cũng cho biết thuốc kháng virus Molnupiravir được sử dụng để điều trị Covid-19 mức độ nhẹ đến trung bình ở người trưởng thành dương tính với xét nghiệm chẩn đoán SARS-CoV-2 và có ít nhất 1 yếu tố nguy cơ làm bệnh tiến triển nặng.
Molnupiravir dùng trên bệnh nhân có thời gian khởi phát triệu chứng dưới 5 ngày, không được sử dụng quá 5 ngày liên tiếp; không được sử dụng để dự phòng sau hay trước phơi nhiễm để phòng Covid-19.
Đối với phụ nữ có thai và cho con bú, Molnupiravir không được khuyến cáo sử dụng trong thời kỳ mang thai. Phụ nữ có khả năng mang thai nên sử dụng biện pháp tránh thai hiệu quả trong thời gian điều trị và trong 4 ngày sau liều Molnupiravir cuối cùng.
Dựa trên khả năng xảy ra các phản ứng có hại cho trẻ sơ sinh từ Molnupiravir, không khuyến cáo cho con bú trong thời gian điều trị và trong 4 ngày sau liều Molnupiravir cuối cùng.
Đối với trẻ em và thanh thiếu niên, Molnupiravir không được phép sử dụng cho bệnh nhân dưới 18 tuổi vì có thể ảnh hưởng đến sự phát triển của xương và sụn.
-
Giao thừa cận kề, bệnh viện vẫn “trực chiến” giành giật sự sống cho bệnh nhân -
Đảm bảo an toàn thực phẩm trong dịp Tết -
Tin mới y tế ngày 16/2: Các bệnh lý tai mũi họng dễ bùng phát dịp Tết Nguyên đán -
Nghi ngộ độc sau ăn bánh mỳ, Bộ Y tế yêu cầu khẩn trương truy xuất nguồn gốc -
Phê duyệt "Chương trình Bảo đảm mức sinh thay thế trên toàn quốc đến năm 2030" -
Bộ Y tế yêu cầu điều tra khẩn vụ nghi ngộ độc sau ăn cá ủ chua tại Đà Nẵng -
Ca ghép gan 6 giờ trước thềm năm mới giành lại sự sống cho bệnh nhân
-
 DragonGroup: Khẳng định nền tảng, đặt mục tiêu bứt phá năm 2026
DragonGroup: Khẳng định nền tảng, đặt mục tiêu bứt phá năm 2026 -
 Agribank triển khai đồng bộ các giải pháp thúc đẩy tài chính toàn diện
Agribank triển khai đồng bộ các giải pháp thúc đẩy tài chính toàn diện -
 Khánh thành, thông xe công trình cầu vượt Thanh Hà
Khánh thành, thông xe công trình cầu vượt Thanh Hà -
 SATRA khai mạc chợ hoa xuân Bình Điền Bính Ngọ
SATRA khai mạc chợ hoa xuân Bình Điền Bính Ngọ -
 Techcombank Private: Kiến tạo tương lai quản lý gia sản tại Việt Nam
Techcombank Private: Kiến tạo tương lai quản lý gia sản tại Việt Nam -
 Vì sao nên sử dụng giải pháp vay kinh doanh của ngân hàng VietinBank?
Vì sao nên sử dụng giải pháp vay kinh doanh của ngân hàng VietinBank?










